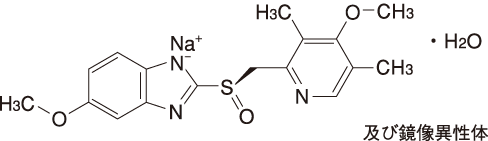
1
Regårdh CG.:Scand. J. Gastroenterol. 1986;21(Suppl.118):99-104
2
Cederberg C., et al.:Scand. J. Gastroenterol. 1989;24(Suppl.166):33-40
3
Andersson T., et al.:Br. J. Clin. Pharmacol. 1993;36:521-530
4
佐藤哲男 他:医薬品トキシコロジー. 南江堂. 1996:33
5
Katsuki H., et al.:Eur. J. Clin. Pharmacol. 1997;52:391-396
6
Yasuda S., et al.:Clin. Pharmacol. Ther. 1995;58:143-154
7
Andersson T., et al.:Eur. J. Clin. Pharmacol. 1990;39:51-54
8
Gugler R., et al.:Gastroenterology. 1985;89:1235-1241
9
Sutfin T., et al.:Ther. Drug Monit. 1989;11:176-184
10
有効性(オメプラール注用:2010年6月29日、再審査報告書)
11
Zollinger-Ellison症候群に対する臨床試験(オメプラール注用:2001年4月4日承認、審査報告書)
12
友井正明 他:日薬理誌. 1988;92:105-111
13
Wallmark B., et al.:J. Biological. Chemistry. 1985;260:13681-13684
14
起原又は発見の経緯及び外国における使用状況等(オメプラール注用:2001年4月4日承認、審査報告書)