1
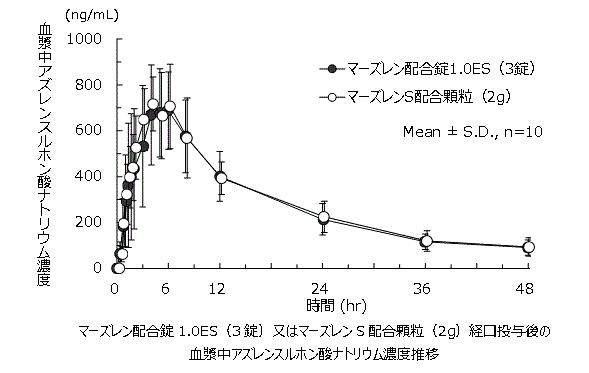
社内資料:マーズレン配合錠1.0ESとマーズレンS配合顆粒の製剤間のヒト生物学的同等性の検証
2
佐藤正雄ほか:薬理と治療.1998;26(4):481-484.
3
三好秋馬ほか:内科宝函.1982;29(5):297-332.
4
関口利和ほか:基礎と臨床.1977;11(2):679-686.
5
小林節雄ほか:新薬と臨牀.1981;30(11):1855-1873.
6
中沢三郎ほか:診療と新薬.1974;11(9):1839-1849.
7
内藤俊一ほか:薬理と治療.1984;12(1):183-186.
8
Martinson EE,et al.:Biokhimiia.1962;27(3):437-441.
9
Leloir LF,et al.:Biochim. Biophys. Acta.1953;12:15-22.
10
林啓一郎ほか:薬理と治療.1998;26(4):465-472.
11
川村武ほか:基礎と臨床.1985;19(13):6443-6446.
12
川村武ほか:基礎と臨床.1985;19(10):5195-5199.
13
堀裕子ほか:薬理と治療.1994;22(9):3777-3783.
14
堀裕子ほか:薬理と治療.1994;22(10):4305-4313.
15
岡部進ほか:応用薬理.1975;9(1):31-37.