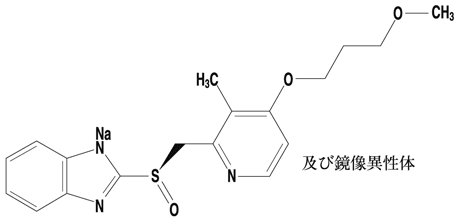
1
Yasuda,S.et al.:Int.J.Clin.Pharmacol.Ther.1994;32(9):466-473
2
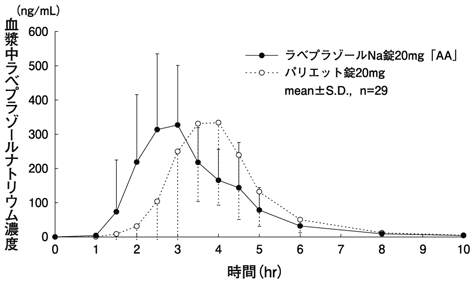
ラベプラゾールナトリウム単剤投与(パリエット錠:2014年12月26日承認、CTD2.7.6.1)
3
社内資料:ラベプラゾールNa錠20mg「AA」生物学的同等性試験
4
Yasuda,S.et al.:Clin.Pharmacol.Ther.1995;58(2):143-154
5
Ishizaki,T.et al.:Aliment.Pharmacol.Ther.1999;13(Suppl.3):27-36
6
Ishizaki,T.et al.:Clin.Pharmacol.Ther.1995;58(2):155-164
7
中澤三郎他:Modern Physician.1994;14(S.):38-68
8
本村 明他:Modern Physician.1994;14(S.):23-37
9
篠村恭久他:Modern Physician.1994;14(S.):69-84
10
八尾恒良他:Modern Physician.1994;14(S.):85-99
11
中川充文他:Modern Physician.1994;14(S.):100-107
12
吉田 豊他:Modern Physician.1994;14(S.):108-115
13
中野 哲他:Modern Physician.1994;14(S.):116-123
14
谷内 昭他:Modern Physician.1994;14(S.):124-136
15
吉田 豊他:Modern Physician.1994;14(S.):137-147
16
Kinoshita,Y.et al.:Am.J.Gastroenterol.2012;107(4):522-530
17
岩崎有良他:薬理と治療.1999;27(4):705-712
18
井上正規他:内科宝函.1994;41(7):143-150
19
Fujisaki,H.et al.:Biochem.Pharmacol.1991;42(2):321-328
20
Fujisaki,H.et al.:Drug Invest.1991;3(5):328-332
21
村上 学他:G.I.Research.1993;1(5):493-496
22
河合 隆他:G.I.Research.1993;1(3):274-280
23
胃内pH上昇作用(パリエット錠:2014年12月26日承認、CTD2.7.6.1)
24
藤崎秀明他:日本薬理学雑誌.1993;102(6):389-397
25
Morii,M.et al.:Biochem.Pharmacol.1990;39(4):661-667
26
村上 学他:G.I.Research.1993;1(5):497-500
27
抗潰瘍作用(パリエット錠:2014年12月26日承認、CTD2.6.2.2)