1
Yasuda, S. et al.:Int. J. Clin. Pharmacol. Ther. 1994;32(9):466-473
2
日本人健康成人男性を対象としたE3810の臨床薬理試験(パリエット錠:2014年12月26日承認、申請資料概要2.7.6.1)
3
3剤併用体内動態試験(国内)の概要(パリエット錠:2007年1月26日承認、申請資料概要2.7.6.1)
4
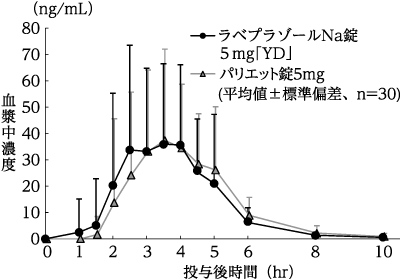
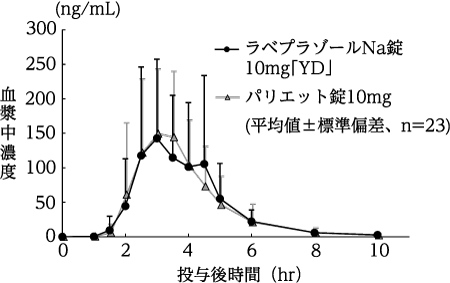
(株)陽進堂社内資料:生物学的同等性試験(錠5mg)
5
(株)陽進堂社内資料:生物学的同等性試験(錠10mg)
6
Yasuda, S. et al.:Clin. Pharmacol. Ther. 1995;58(2):143-154
7
Ishizaki, T. et al.:Aliment. Pharmacol. Ther. 1999;13(Suppl.3):27-36
8
Ishizaki, T. et al.:Clin. Pharmacol. Ther. 1995;58(2):155-164
9
中澤三郎 他:Modern Physician. 1994;14(S.):38-68
10
本村明 他:Modern Physician. 1994;14(S.):23-37
11
篠村恭久 他:Modern Physician. 1994;14(S.):69-84
12
八尾恒良 他:Modern Physician. 1994;14(S.):85-99
13
中川充文 他:Modern Physician. 1994;14(S.):100-107
14
吉田豊 他:Modern Physician. 1994;14(S.):108-115
15
中野哲 他:Modern Physician. 1994;14(S.):116-123
16
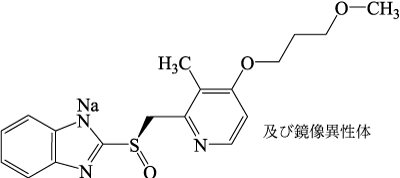
谷内昭 他:Modern Physician. 1994;14(S.):124-136
17
吉田豊 他:Modern Physician. 1994;14(S.):137-147
18
中澤三郎 他:Modern Physician. 1994;14(S.):1-22
19
国内における臨床試験成績(パリエット錠:2003年7月17日承認、申請資料概要ト.1.(5)-Ⅱ)
20
Kinoshita, Y. et al.:Am. J. Gastroenterol. 2012;107(4):522-530
21
Kinoshita, Y. et al.:Gastroenterol. 2018;53(7):834-844
22
国内第Ⅲ相試験(パリエット錠:2017年9月22日承認、審査報告書)
23
Kinoshita, Y. et al.:Aliment. Pharmacol. Ther. 2011;33(2):213-224
24
Iwakiri, R. et al.:Aliment. Pharmacol. Ther. 2014;40(7):780-795
25
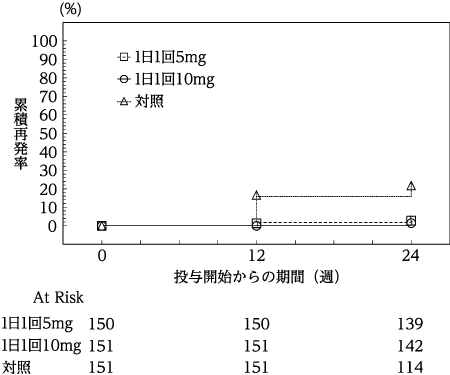
低用量アスピリン投与中かつ胃潰瘍又は十二指腸潰瘍の既往歴を有する患者を対象とした第Ⅱ/Ⅲ相試験(パリエット錠:2014年12月26日承認、申請資料概要2.7.6.2)
26
低用量アスピリン投与中かつ308試験の24週後内視鏡検査にて潰瘍非再発が確認された患者を対象とした長期投与試験(パリエット錠:2014年12月26日承認、申請資料概要2.7.6.3)
27
Kuwayama, H. et al.:Aliment. Pharmacol. Ther. 2007;25(9):1105-1113
28
国内第Ⅲ相試験の概要(パリエット錠:2007年1月26日承認、申請資料概要2.7.6.3)
29
全有効性試験の結果の比較検討(パリエット錠:2007年1月26日承認、申請資料概要2.7.3.3)
30
Isomoto, H. et al.:Aliment. Pharmacol. Ther. 2003;18(1):101-107
31
第十八改正日本薬局方解説書 廣川書店. 2021;C5995-6001
32
Fujisaki, H. et al.:Biochem. Pharmacol. 1991;42(2):321-328
33
藤崎秀明 他:日本薬理学雑誌. 1993;102(6):389-397
34
岩崎有良 他:薬理と治療. 1999;27(4):705-712
35
井上正規 他:内科宝函. 1994;41(7):143-150
36
Fujisaki, H. et al.:Drug Invest. 1991;3(5):328-332
37
村上学 他:G. I. Research. 1993;1(5):493-496
38
河合隆 他:G. I. Research. 1993;1(3):274-280
39
Morii, M. et al.:Biochem. Pharmacol. 1990;39(4):661-667
40
村上学 他:G. I. Research. 1993;1(5):497-500
41
ラットにおけるアスピリン胃潰瘍に対する作用(パリエット錠:2014年12月26日承認、申請資料概要2.6.2.2)
42
考察及び結論(パリエット錠:2007年1月26日承認、申請資料概要2.6.2.6)
43
ラベプラゾールナトリウム、アモキシシリン、メトロニダゾール併用投与の有効性(パリエット錠:2007年8月23日承認、審査報告書)
44
スナネズミH. pylori胃内感染モデルにおける除菌効果(パリエット錠:2007年1月26日承認、申請資料概要2.6.2.1)




 0120-647-734
0120-647-734

