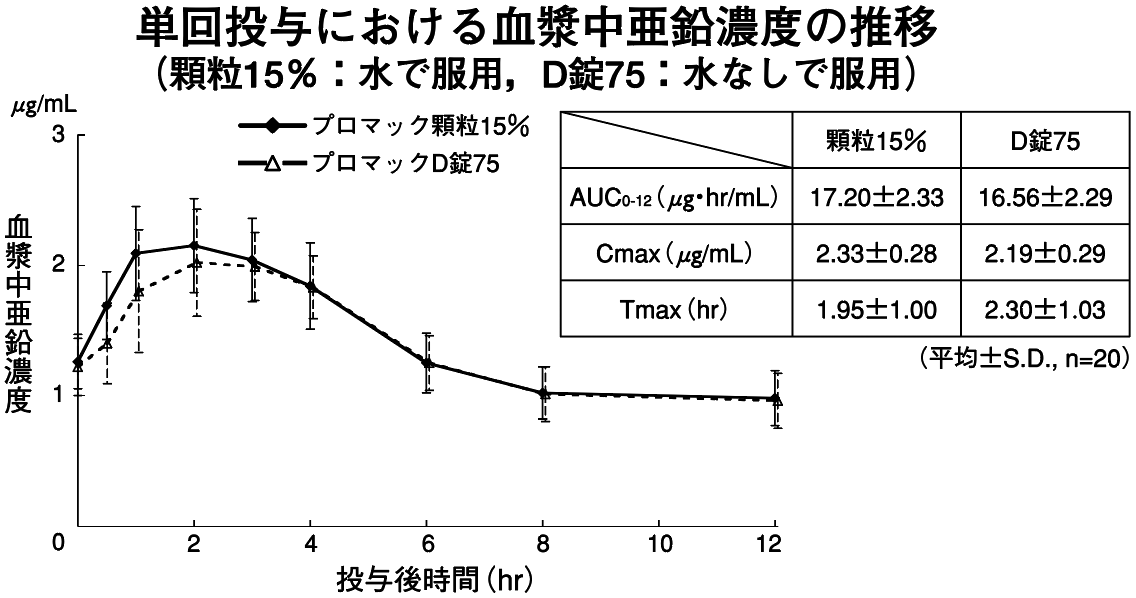
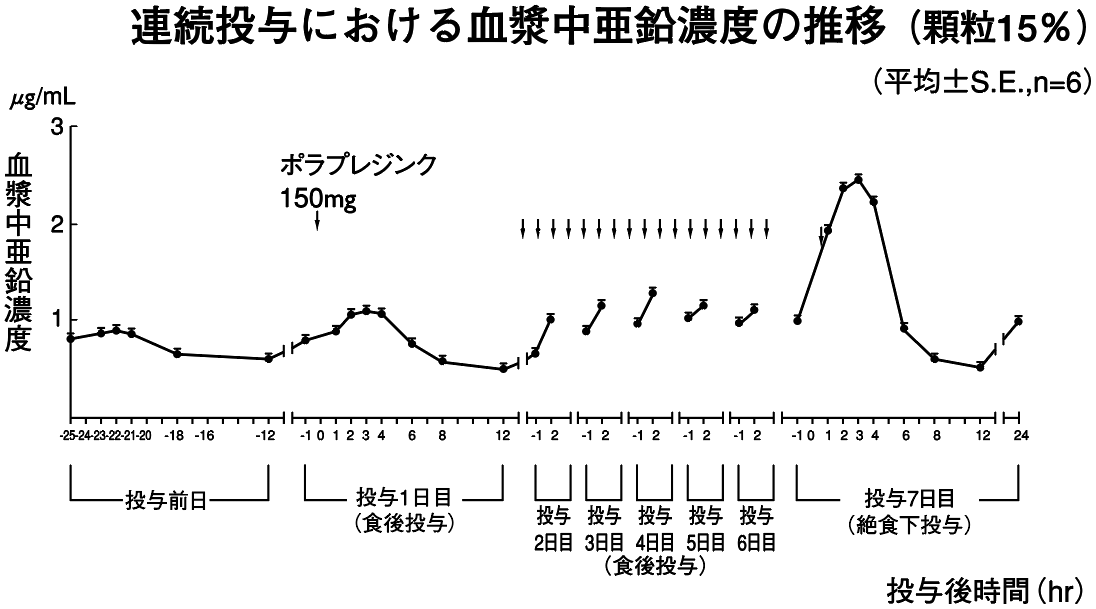
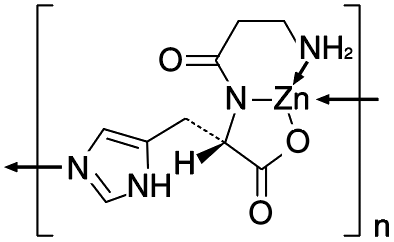
1
金子淳二:Jpn.Pharmacol.Ther.,2006; 34(6),675-682
2
柴田久雄:薬理と治療,1992; 20(1),149-163
3
会田浩幸 他:Ther.Res.,1992; 13(6),2413-2422
4
佐野 廣 他:Arzneim.Forsch/Drug Res.,1991; 41(II),965-975
5
外山誠司 他:Arzneim.Forsch/Drug Res.,1991; 41(II),976-983
6
古田 盛 他:薬物動態,1993; 8(5),1057-1063
7
三好秋馬 他:薬理と治療,1992; 20(1),199-223
8
岡部和彦 他:薬理と治療,1992; 20(1),265-273
9
清木雅雄 他:日薬理誌,1992; 99(4),255-263
10
清木雅雄 他:日薬理誌,1992; 100(2),165-172
11
会田浩幸 他:日薬理誌,1992; 99(5),345-352
12
荒川哲男 他:Dig.Dis.Sci.,1990; 35(5),559-566
13
清木雅雄 他:日薬理誌,1990; 95(5),257-269
14
清木雅雄 他:Ther.Res.,1991; 12(10),3243-3251
15
森田 仁 他:Ther.Res.,1992; 13(2),877-883
16
伊藤幹雄 他:J.J.Pharmacol.,1990; 52(4),513-521
17
米田智幸 他:Ther.Res.,1994; 15(11),4563-4569
18
上木 茂 他:Ther.Res.,1992; 13(2),851-855
19
堀 裕子 他:Ther.Res.,1992; 13(2),857-861
20
清木雅雄 他:内科宝函,1992; 39(1),21-25
21
C.H.Cho 他:Life Sciences,1991; 49(23),189-194
22
吉川敏一 他:Biochim.Biophys.Acta,1991; 1115(1),15-22
23
米田智幸 他:医学のあゆみ,1990; 154(8),501-502
24
吉川敏一 他:J.Clin.Biochem.Nutr.,1989; 7(2),107-113
25
吉川敏一 他:Free Rad.Res.Comms.,1991; 14(4),289-296