添付文書番号
2329027D1052_1_06
企業コード
530113
作成又は改訂年月
日本標準商品分類番号
872329
薬効分類名
亜鉛含有胃潰瘍治療剤
承認等
販売名
ポラプレジンク顆粒15%「NS」
販売名コード
販売名英字表記
Polaprezinc Granules 15% “NS”
販売名ひらがな
ぽらぷれじんくかりゅう15%「NS」
承認番号等
販売開始年月
貯法、有効期間
基準名
一般的名称
ポラプレジンク
組成・性状
組成
ポラプレジンク顆粒15%「NS」
有効成分 | 1g中
日本薬局方ポラプレジンク 150mg |
|---|
添加剤 | D-マンニトール、トウモロコシデンプン、カルメロースカルシウム、ポビドン、アミノアルキルメタクリレートコポリマーE |
|---|
製剤の性状
効能又は効果
用法及び用量
通常、成人にはポラプレジンクとして1回75mgを1日2回朝食後及び就寝前に経口投与する。なお、年齢、症状により適宜増減する。
特定の背景を有する患者に関する注意
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行がみられたとの報告がある。
小児等
高齢者
減量(1日100mg)するなど患者の状態を観察しながら投与することが望ましい。一般に消化器機能が低下していることがある。
相互作用
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
ペニシラミン製剤 | 同時に服用することにより、併用薬剤の効果を減弱するおそれがあるので、やむを得ず投与する場合には、同時に服用させないなど注意して投与すること。 | 同時投与した場合、本剤が併用薬剤とキレートを形成し、吸収を低下させる可能性がある。 |
レボチロキシンナトリウム | 同時に服用することにより、併用薬剤の効果を減弱するおそれがあるので、やむを得ず投与する場合には、同時に服用させないなど注意して投与すること。 | 同時投与した場合、本剤が併用薬剤とキレートを形成し、吸収を低下させる可能性がある。 |
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTP、Al-Pの上昇等の肝機能障害、黄疸があらわれることがある。
銅欠乏症(頻度不明)
本剤は亜鉛を含有するため、亜鉛により銅の吸収が阻害され銅欠乏症を起こすことがある。栄養状態不良の患者で銅欠乏に伴う汎血球減少や貧血が報告されている。
その他の副作用
| 0.1%~1%未満 | 0.1%未満 | 頻度不明 |
|---|
過敏症 | | 発疹、そう痒感 | 蕁麻疹 |
|---|
血液 | 好酸球増多、白血球減少、血小板減少 | | |
|---|
肝臓 | AST上昇、ALT上昇、Al-P上昇、LDH上昇、γ-GTP上昇 | | |
|---|
消化器 | 便秘、嘔気、腹部膨満感 | 嘔吐、胸やけ、下痢 | |
|---|
注)発現頻度の算出には使用成績調査を含む
薬物動態
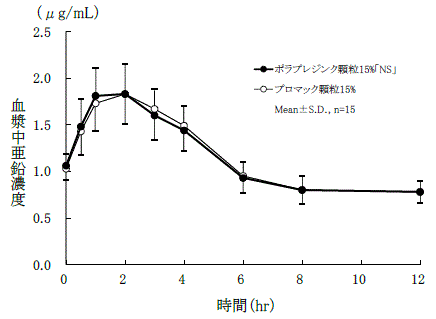
血中濃度
生物学的同等性試験
ポラプレジンク顆粒15%「NS」とプロマック顆粒15%を、クロスオーバー法によりそれぞれ0.5g(ポラプレジンクとして75mg)健康成人男子に絶食時単回経口投与して血漿中亜鉛濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.8)~log(1.25)の範囲内であり、両製剤の生物学的同等性が確認された 。
| 判定パラメータ | 参考パラメータ |
AUC0-12
(μg・hr/mL) | Cmax
(μg/mL) | Tmax
(hr) |
ポラプレジンク顆粒
15%「NS」 | 13.79±1.86 | 1.95±0.24 | 1.7±0.8 |
プロマック顆粒
15% | 13.88±1.58 | 1.90±0.19 | 1.5±0.5 |
血漿中亜鉛濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
薬効薬理
生物学的同等性試験
塩酸-エタノール胃粘膜損傷モデルにおける胃粘膜損傷発生抑制作用
一晩絶食したラットにポラプレジンク顆粒15%「NS」とプロマック顆粒15%を、それぞれポラプレジンクとして8mg/kg経口投与し、30分後に塩酸-エタノール1mLを経口投与し胃粘膜損傷モデルを作成した。塩酸-エタノール投与から1時間後に胃粘膜損傷の長さの測定を行ったところ、プラセボと比較して、両製剤とも同様の有意な胃粘膜損傷発生抑制作用を示した。また、統計解析を行った結果、両製剤の生物学的同等性が確認された 。
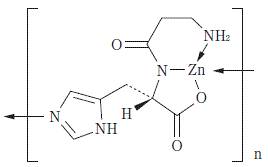
有効成分に関する理化学的知見
一般的名称
ポラプレジンク(Polaprezinc)
化学名
catena-Poly{zinc-μ-[β-alanyl-L-histidinato(2-)- N,N N,O : N τ]}
分子式
(C9H12N4O3Zn)n
性状
白色~微黄白色の結晶性の粉末である。水、メタノール又はエタノール(99.5)にほとんど溶けない。希塩酸に溶ける。
化学構造式
取扱い上の注意
包装
主要文献
文献請求先及び問い合わせ先
〒994-0069 山形県天童市清池東二丁目3番1号
製造販売業者等