1
社内資料:生物学的同等性試験
2
清木雅雄 他:日薬理誌,1992; 99(4),255-263
3
清木雅雄 他:日薬理誌,1992; 100(2),165-172
4
会田浩幸 他:日薬理誌,1992; 99(5),345-352
5
荒川哲男 他:Dig.Dis.Sci.,1990; 35(5),559-566
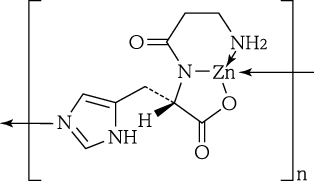
亜鉛含有胃潰瘍治療剤
1g 31.8円
有効成分 | 1g中 日局 ポラプレジンク 150mg |
|---|---|
添加剤 | D-マンニトール、クエン酸二ナトリウム、トウモロコシデンプン、ポビドン、カルメロースカルシウム、ヒプロメロース、タルク、軽質無水ケイ酸 |
| 識別コード | chPC |
|---|---|
| 色調・剤形 | 微黄白色の顆粒 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
ペニシラミン製剤 | 同時に服用することにより、併用薬剤の効果を減弱するおそれがあるので、やむを得ず投与する場合には、同時に服用させないなど注意して投与すること。 | 同時投与した場合、本剤が併用薬剤とキレートを形成し、吸収を低下させる可能性がある。 |
レボチロキシンナトリウム | 同時に服用することにより、併用薬剤の効果を減弱するおそれがあるので、やむを得ず投与する場合には、同時に服用させないなど注意して投与すること。 | 同時投与した場合、本剤が併用薬剤とキレートを形成し、吸収を低下させる可能性がある。 |
0.1%~1%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|
過敏症 | 発疹、そう痒感 | 蕁麻疹 | |
血液 | 好酸球増多、白血球減少、血小板減少 | ||
肝臓 | AST上昇、ALT上昇、Al-P上昇、LDH上昇、γ-GTP上昇 | ||
消化器 | 便秘、嘔気、腹部膨満感 | 嘔吐、胸やけ、下痢 |
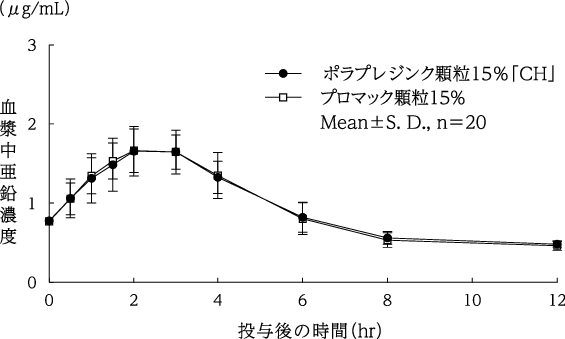
判定パラメータ | 参考パラメータ | |||
AUC0-12 (μg・hr/mL) | Cmax (μg/mL) | Tmax (hr) | t1/2 (hr) | |
11.3±1.1 | 1.8±0.2 | 2.4±0.5 | 6.4±3.5 | |
プロマック顆粒15% | 11.2±1.4 | 1.8±0.3 | 2.5±0.5 | 5.8±2.3 |