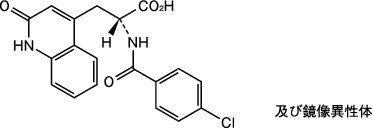
1
Hasegawa, S. et al.:Clin Drug Invest. 2003;23(12):771-779.
2
岸 清一郎 ほか:臨床成人病. 1989;19(3):355-363.
3
塩屋良秀 ほか:医薬品研究. 1989;20(2):522-533.
4
Koyama, N. et al.:XENOBIOTICA. 2002;32(7):573-586.
5
菊池 博 ほか:新薬と臨床. 1995;44(7):1179-1182.
6
深沢和浩 ほか:新薬と臨床. 1995;44(10):1667-1671.
7
竹本忠良 ほか:臨床成人病. 1989;19(4):539-551.
8
竹本忠良 ほか:臨床成人病. 1989;19(4):553-582.
9
竹本忠良 ほか:臨床成人病. 1989;19(5):739-751.
10
竹本忠良 ほか:臨床成人病. 1989;19(5):753-775.
11
竹本忠良 ほか:臨床成人病. 1989;19(7):1265-1291.
12
竹本忠良 ほか:臨床成人病. 1993;23(8):1163-1190.
13
小林絢三 ほか:臨床成人病. 1993;23(7):1003-1028.
14
山崎勝也 ほか:薬理と治療. 1988;16(5):1997-2005.
15
Yamasaki, K. et al.:Jpn J Pharmacol. 1989;49(4):441-448.
16
白木正裕 ほか:日薬理誌. 1988;92(6):389-395.
17
岡部 進 ほか:Ther Res. 1991;12(10):3253-3263.
18
Kishimoto, S. et al.:Res Commun Chem Pathol Pharmacol. 1992;78(3):259-277.
19
Yamasaki, K. et al.:Eur J Pharmacol. 1987;142(1):23-29.
20
Kleine, A. et al.:Dig Dis Sci. 1993;38(8):1441-1449.
21
中村 肇 ほか:臨床成人病. 1989;19(6):1109-1114.
22
川野 淳 ほか:日薬理誌. 1991;97(6):371-380.
23
Dammann, H. G.:Eur J Gastroenterol Hepatol. 1994;6(10):911-915.
24
石山広信 ほか:薬理と治療. 1988;16(10):4103-4109.
25
石山広信 ほか:薬理と治療. 1988;16(10):4111-4118.
26
Ishihara, K. et al.:Arzneim-Forsch/Drug Res. 1992;42(II):1462-1466.
27
山崎勝也 ほか:薬理と治療. 1990;18(9):3395-3400.
28
山崎勝也 ほか:薬理と治療. 1990;18(10):3765-3772.
29
Watanabe, S. et al.:Aliment Pharmacol Ther. 1996;10(6):927-932.
30
Watanabe, S. et al.:Dig Dis Sci. 1998;43(9):107S-112S.
31
山崎勝也 ほか:薬理と治療. 1988;16(6):2487-2495.
32
Yoshikawa, T. et al.:Arzneim-Forsch/Drug Res. 1993;43(I):363-366.
33
Naito, Y. et al.:Free Radic Biol Med. 1995;18(1):117-123.
34
Ogino, K. et al.:Eur J Pharmacol. 1992;212(1):9-13.
35
Suzuki, M. et al.:Gut. 1994;35(10):1375-1378.
36
Yamasaki, K. et al.:Pathophysiology. 1994;1(4):251-257.
37
Murakami, K. et al.:Dig Dis Sci. 1997;42(2):319-325.
38
Kim, C. D. et al.:J Pharmacol Exp Ther. 1995;275(1):340-344.
39
三原充弘 ほか:消化器科. 1997;24(6):681-688.
40
Aihara, M. et al.:Dig Dis Sci. 1998;43(9):174S-180S.