1
春木左千夫 他 : 薬理と治療. 1995 ; 23(11): 3049-3059
2
古橋三義 他 : 透析会誌. 2002 ; 35(1): 35-42
3
森賀本幸 他 : 臨床医薬. 1995(1998年改訂); 11(Suppl. 4): 3-21
4
森賀本幸 他 : 臨床医薬. 1995(1998年改訂); 11(Suppl. 4): 23-34
5
中澤三郎 他 : 臨床医薬. 1995(1998年改訂); 11(Suppl. 4): 35-48
6
三輪剛 他 : 臨床医薬. 1995(1998年改訂); 11(Suppl. 4): 49-62
7
早川滉 : 臨床医薬. 1995(1998年改訂); 11(Suppl. 4): 75-85
8
森治樹 : 臨床医薬. 1995(1998年改訂); 11(Suppl. 4): 87-96
9
三輪剛 他 : 臨床医薬. 1995(1998年改訂); 11(Suppl. 4): 63-74
10
松尾裕 他 : 臨床医薬. 1998 ; 14(11): 2085-2102
11
松尾裕 他 : 臨床医薬. 1998 ; 14(11): 2103-2119
12
三好秋馬他 : 臨床医薬. 1995(1998年改訂); 11(Suppl. 4): 97-111
13
三好秋馬他 : 臨床医薬. 1995(1998年改訂); 11(Suppl. 4): 113-129
14
三好秋馬 他 : 臨床医薬. 1998 ; 14(11): 2121-2138
15
野口純一 他 : 臨床医薬. 1995(1998年改訂); 11(Suppl. 4): 159-171
16
野口純一 他 : 臨床医薬. 1995 ; 11(10): 2143-2158
17
Ohara, S., et al. : J. Gastroenterol. 2010 ; 45 : 1219-1227
18
森治樹 他 : 臨床医薬. 1995 ; 11(7): 1381-1393
19
森治樹 他 : 臨床医薬. 1995 ; 11(7): 1395-1407
20
森治樹 他 : 臨床医薬. 1995 ; 11(7): 1409-1422
21
谷礼夫 他 : 臨床医薬. 1995 ; 11(8): 1667-1678
22
森治樹 他 : 消化器の臨床. 2002 ; 5(2): 200-206
23
Ichikawa, T., et al. : J. Gastroenterol. Hepatol. 2007 ; 22(11): 1800-1805
24
Shibata, M., et al. : Eur. J. Pharmacol. 1993 ; 235 : 245-253
25
稲葉二朗 他 : 日薬理誌. 1995 ; 105(4): 231-241
26
Onodera, S., et al. : Jpn. J. Pharmacol. 1995 ; 68(2): 161-173
27
山浦哲明 他 : 日薬理誌. 1992 ; 99(6): 401-410
28
小野寺禎良 他 : 日薬理誌. 1998 ; 111(3): 167-175
29
Ajioka, H., et al. : Pharmacology. 2000 ; 61(2): 83-90
30
小野寺禎良 他 : 日薬理誌. 1997 ; 109(1): 31-40
31
中野素子 他:Lafutidineのラット急性逆流性食道炎モデルにおける食道粘膜傷害抑制作用の多剤比較, 社内資料, 研究報告書No.354
32
柴田昌裕 他 : 実験潰瘍. 1997 ; 24(1): 33-37
33
Ichikawa, T., et al. : Eur. J. Pharmacol. 1994 ; 251 : 107-111
34
Ichikawa, T., et al. : Life Sci. 1994 ; 54(10): 159-164
35
鹿児島正豊 他 : 日薬理誌. 1994 ; 104(5): 379-389
36
小野寺禎良 他 : 実験潰瘍. 1998 ; 25(2): 217-220



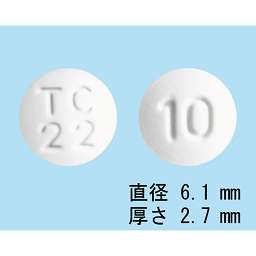




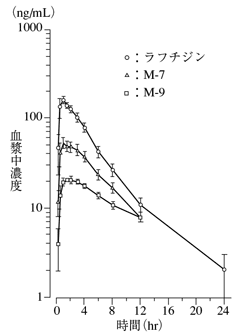
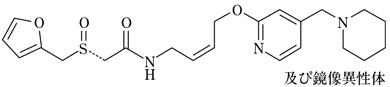



腎機能低下傾向者:Ccr=20、34、54、58、60mL/min(5例)