1
猪爪信夫 他:Prog.Med.1996;16(11):2897-2903
2
二木芳人:Today’s Therapy.1994;18(2):42-45
3
Lim,S.G.et al.:Aliment.Pharmacol.Ther.1993;7:317-321
4
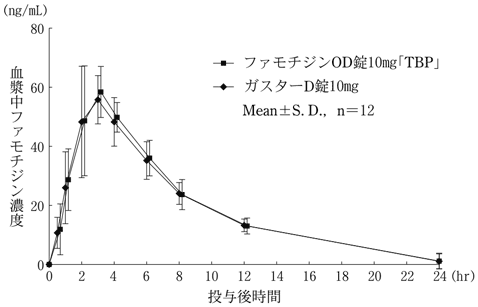
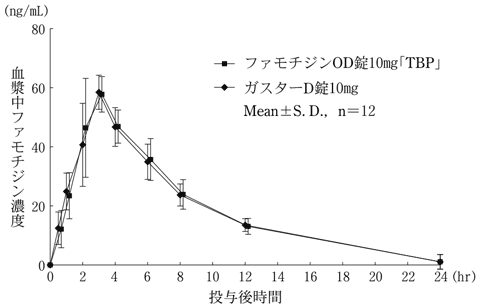
社内資料:生物学的同等性試験(10mg)
5
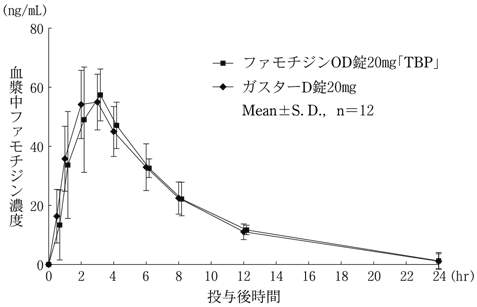
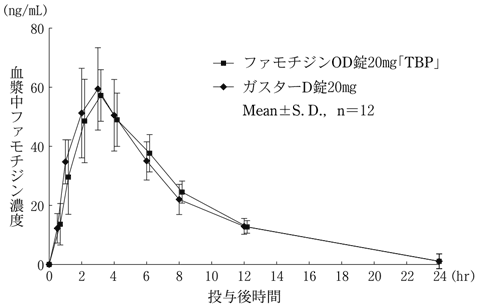
社内資料:生物学的同等性試験(20mg)
6
第十八改正日本薬局方解説書,廣川書店.2021;C-4521-4524
7
大江慶治 他:内科宝函.1983;30(11):365-378
8
大江慶治 他:内科宝函.1984;31(1):11-24
9
渡部洋三 他:薬理と治療.1983;11(9):3637-3650
10
三好秋馬 他:基礎と臨床.1983;17(9):2909-2916
11
三好秋馬 他:基礎と臨床.1983;17(9):2917-2927
12
大江慶治 他:内科宝函.1984;31(2):51-62
13
池添逸夫 他:日本消化器病学会雑誌.1983;80(Suppl.):694
14
Miwa,M.et al.:Int.J.Clin.Pharmacol.Ther.Toxicol.1984;22(4):214-217
15
宮本二郎 他:薬理と治療.1983;11(9):3651-3658
16
森 治樹:日本臨床.1984;42(1):150-157
17
原沢 茂 他:診療と新薬.1983;20(9):1859-1864
18
大西久仁彦 他:薬理と治療.1983;11(10):4301-4304
19
三好秋馬 他:新薬と臨床.1983;32(9):1383-1395
20
早川 滉 他:臨床成人病.1984;14(4):571-577
21
竹田正明 他:基礎と臨床.1983;17(9):2878-2882
22
Takeda,M.et al.:Eur.J.Pharmacol.1983;91(4):371-376
23
Takagi,T.et al.:Arch.Int.Pharmacodyn.Ther.1982;256(1):49-58
24
竹田正明 他:基礎と臨床.1984;18(12):6125-6134
25
Takeda,M.et al.:Arzneimittel-Forschung.1982;32(7):734-737
26
岡部 進 他:応用薬理.1984;27(3):563-569
27
Ishihara,Y.et al.:Digestion.1983;27(1):29-35
28
宮田桂司 他:基礎と臨床.1987;21(16):6063-6073