1
猪爪信夫 他:Prog.Med.1996;16(11):2897-2903
2
二木芳人:Today’s Therapy.1994;18(2):42-45
3
Lim, S.G. et al.:Aliment.Pharmacol. Ther.1993;7:317-321
4
シオノケミカル株式会社:生物学的同等性に関する資料(社内資料)
5
第十八改正日本薬局方解説書 廣川書店 2021:C4521-4526
H2受容体拮抗剤
1錠 10.1円
| 有効成分 (1錠中) | (日局)ファモチジン 10mg |
|---|---|
| 添加剤 | 結晶セルロース、トウモロコシデンプン、デンプングリコール酸ナトリウム、ステアリン酸マグネシウム、乳糖水和物、ヒプロメロース、マクロゴール6000、マクロゴール400、プロピレングリコール、タルク、酸化チタン、カルナウバロウ |
| 有効成分 (1錠中) | (日局)ファモチジン 20mg |
|---|---|
| 添加剤 | 結晶セルロース、トウモロコシデンプン、デンプングリコール酸ナトリウム、ステアリン酸マグネシウム、乳糖水和物、ヒプロメロース、マクロゴール6000、マクロゴール400、プロピレングリコール、タルク、酸化チタン、カルナウバロウ |
| 性状 | 白色~微黄白色のフィルムコーティング錠 |
|---|---|
| 外形 | 表  裏  側面  |
| 直径 | 6.7mm |
| 厚さ | 2.9mm |
| 重量 | 102mg |
| 識別コード | FG 10 |
| 性状 | 白色~微黄白色のフィルムコーティング錠 |
|---|---|
| 外形 | 表  裏  側面  |
| 直径 | 8.2mm |
| 厚さ | 3.8mm |
| 重量 | 200mg |
| 識別コード | FG 20 |
クレアチニンクリアランス (mL/min) | 投与法 |
Ccr≧60 | 1回20mg 1日2回 |
60>Ccr>30 | 1回20mg 1日1回 1回10mg 1日2回 |
30≧Ccr | 1回20mg 2~3日に1回 1回10mg 1日1回 |
透析患者 | 1回20mg 透析後1回 1回10mg 1日1回 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
アゾール系抗真菌薬 イトラコナゾール | 左記の薬剤の血中濃度が低下する。 | 本剤の胃酸分泌抑制作用が左記薬剤の経口吸収を低下させる,。 |
0.1~5%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|
過敏症 | 発疹・皮疹、蕁麻疹(紅斑)、顔面浮腫 | ||
血液 | 白血球減少 | 好酸球増多 | |
消化器 | 便秘 | 下痢・軟便、口渇、悪心・嘔吐、腹部膨満感、食欲不振、口内炎 | |
循環器 | 血圧上昇、顔面潮紅、耳鳴 | 徐脈、頻脈、房室ブロック | |
肝臓 | AST上昇、ALT上昇、Al-P上昇 | 総ビリルビン上昇、LDH上昇 | 肝機能異常、黄疸 |
精神神経系 | 全身倦怠感、無気力感、頭痛、眠気、不眠 | 可逆性の錯乱状態、うつ状態、痙攣、意識障害、めまい | |
内分泌系 | 月経不順、女性化乳房 | 乳汁漏出症 | |
その他 | CK上昇、味覚異常、筋肉痛、背部痛 |
判定パラメータ | 参考パラメータ | |||
AUC0→24 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
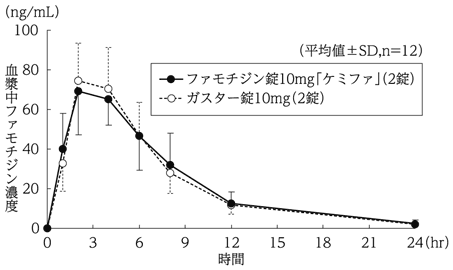
ファモチジン錠10mg 「ケミファ」 (2錠) | 580.2±155.5 | 75.7±16.8 | 2.7±1.0 | 4.6±1.0 |
ガスター錠10mg(2錠) | 571.0±152.8 | 79.2±17.3 | 2.8±1.0 | 4.6±1.0 |
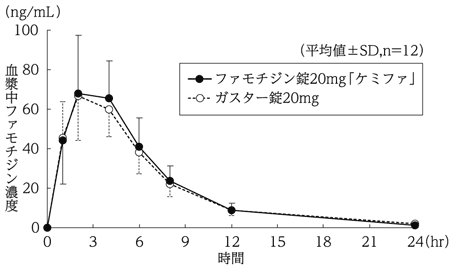
判定パラメータ | 参考パラメータ | |||
AUC0→24 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
ファモチジン錠20mg 「ケミファ」 | 510.0±151.7 | 75.9±27.2 | 3.0±1.0 | 4.0±1.0 |
ガスター錠20mg | 491.1±106.5 | 69.0±20.8 | 2.8±1.0 | 5.0±1.6 |