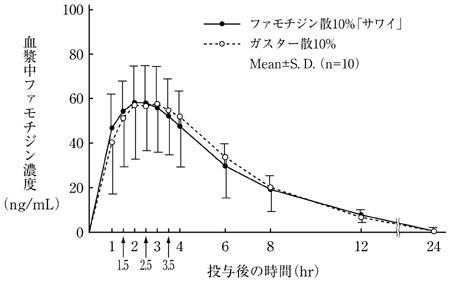
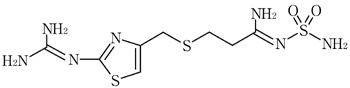
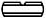1
猪爪信夫他:Prog. Med., 1996;16(11):2897-2903
2
二木芳人:Todayʼs Therapy, 1994;18(2):42-45
3
Lim, S. G. et al.:Aliment. Pharmacol. Ther., 1993;7:317-321
4
中川路桂他:医学と薬学, 2002;48(1):59-65
5
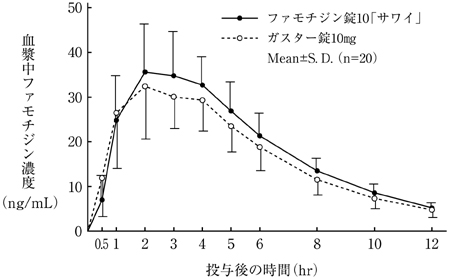
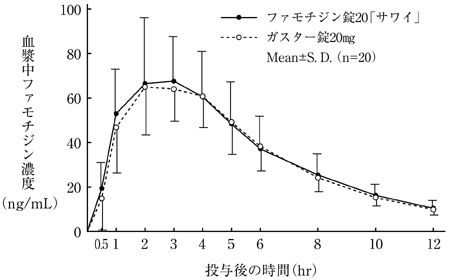
社内資料:生物学的同等性試験(細粒2%)
6
社内資料:生物学的同等性試験(散10%)
7
第十八改正日本薬局方解説書, 廣川書店, 2021;C-4521-4524
8
大江慶治他:内科宝函, 1983;30(11):365-378
9
大江慶治他:内科宝函, 1984;31(1):11-24
10
渡部洋三他:薬理と治療, 1983;11(9):3637-3650
11
三好秋馬他:基礎と臨床, 1983;17(9):2909-2916
12
三好秋馬他:基礎と臨床, 1983;17(9):2917-2927
13
大江慶治他:内科宝函, 1984;31(2):51-62
14
池添逸夫他:日本消化器病学会雑誌, 1983;80(Suppl.):694
15
Miwa, M. et al.:Int. J. Clin. Pharmacol. Ther. Toxicol., 1984;22(4):214-217
16
宮本二郎他:薬理と治療, 1983;11(9):3651-3658
17
森治樹:日本臨床, 1984;42(1):150-157
18
原沢茂他:診療と新薬, 1983;20(9):1859-1864
19
大西久仁彦他:薬理と治療, 1983;11(10):4301-4304
20
三好秋馬他:新薬と臨床, 1983;32(9):1383-1395
21
早川滉他:臨床成人病, 1984;14(4):571-577
22
竹田正明他:基礎と臨床, 1983;17(9):2878-2882
23
Takeda, M. et al.:Eur. J. Pharmacol., 1983;91(4):371-376
24
Takagi, T. et al.:Arch. Int. Pharmacodyn. Ther., 1982;256(1):49-58
25
竹田正明他:基礎と臨床, 1984;18(12):6125-6134
26
Takeda, M. et al.:Arzneimittel-Forschung, 1982;32(7):734-737
27
岡部進他:応用薬理, 1984;27(3):563-569
28
Ishihara, Y. et al.:Digestion, 1983;27(1):29-35
29
宮田桂司他:基礎と臨床, 1987;21(16):6063-6073