1
深瀬広幸 他:アレルギー・免疫, 2009;16(10):1586-602
2
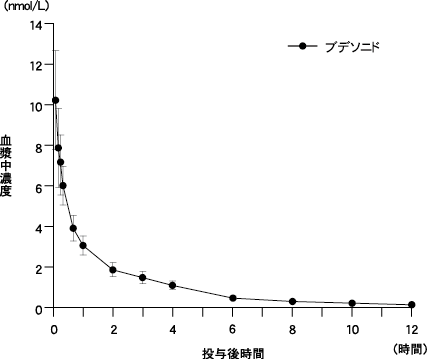
社内資料:ブデソニドのin vitro血漿蛋白結合, 1995
3
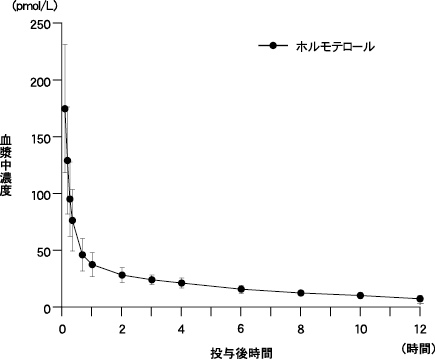
社内資料:ホルモテロールフマル酸塩のin vitro血漿蛋白結合(843-RD-0354)(2009年10月16日承認、CTD2.7.2.2)
4
宮本昭正 他:アレルギーの領域, 1997;4(S-1):18-25
5
社内資料:ホルモテロール吸入投与時の肺内到達率(SD-037-0602)(2009年10月16日承認、CTD2.7.2.2)
6
社内資料:ブデソニドのヒトにおける代謝排泄, 1984
7
Jönsson G, et al. Drug Metab Dispos. 1995;23:137-42
8
Rosenborg J, et al. Drug Metab Dispos. 1999;27:1104-16
9
社内資料:ホルモテロールのシトクロムP450阻害作用の検討(843-RD-0395)(2009年10月16日承認、CTD2.7.2.2)
10
社内資料:シムビコートと各単剤の血漿中濃度の比較(SD-039-0259)(2009年10月16日承認、CTD2.7.1.2)
11
Seidegård J. Clin Pharmacol Ther. 2000;68:13-7
12
Raaska K, et al. Clin Pharmacol Ther. 2002;72:362-9
13
大田 健 他:アレルギー・免疫, 2010;17(4):624-38
14
足立 満:アレルギー・免疫, 2010;17(2):266-82
15
Atienza T, et al. Respirology. 2013;18(2):354-63
16
Rabe KF, et al. Lancet. 2006;368:744-53
17
Kuna P, et al. Int J Clin Pract. 2007;61:725-36
18
Bousquet J, et al. Respir Med. 2007;101:2437-46
19
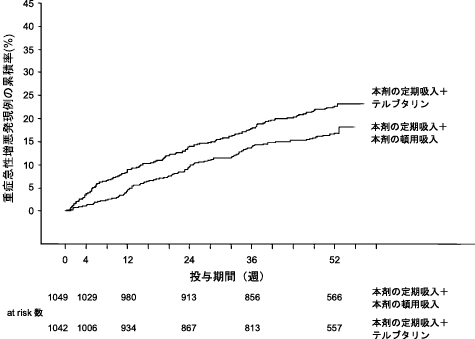
社内資料:シムビコートの慢性閉塞性肺疾患患者における国際共同第III相比較試験(2012年8月10日承認、CTD2.7.3.3)
20
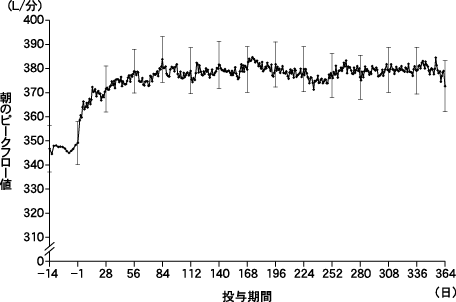
社内資料:シムビコートの日本人慢性閉塞性肺疾患患者における第III相長期投与試験(2012年8月10日承認、CTD2.7.3.3)
21
Calverley PM, et al. Eur Respir J. 2003;22:912-9
22
Szafranski W, et al. Eur Respir J. 2003;21:74-81
23
Brattsand R, et al. Clin Ther. 2003;25(Suppl C):C28
24
Edsbäcker S, et al. Annals of Allergy Asthma & Immunology. 2002;88(6):609-16
25
Ullman A, et al. Allergy. 1992;47:384-7
26
Barnes PJ. Eur Respir J. 2002;19:182-91
27
Roth M, et al. The Lancet. 2002;360:1293-9
28
Linden M, et al. Pulm Pharmacol. 1994;7:43-7
29
Woolley MJ, et al. J Appl Physiol. 1994;77:1303-8
30
社内資料:呼吸困難症SD系ラットにおける卵白アルブミン誘発気道/肺過敏反応及び炎症細胞に対する作用, 1995
31
Svensjö E, et al. Prog Resp Res. 1985;19:173-80
32
Brattsand R, et al. Amsterdam, Excerpta Medica. Proceeding from a Symposium in Basel. 1984;145-53
33
O' Riordan TG, et al. J Appl Physiol. 1998;85(3):1086-91
34
Abraham WM, et al. Bull Eur Physiopathol Respir. 1986;22:387-92
35
Ida H. Arzneimittelforschung. 1976;26(7):1337-40
36
Selroos O. et al. Pulm Pharmacol Ther. 2002;15:175-83
37
Korn SH, et al. Eur Respir J. 2001;17:1070-7
38
社内資料:アレルギーラットモデルの気道過敏性及び炎症に及ぼす影響(2009年10月16日承認、CTD2.6.2.2)