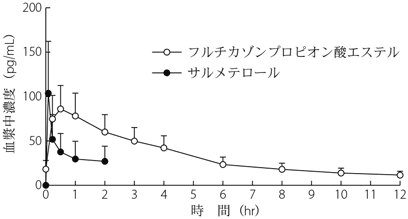
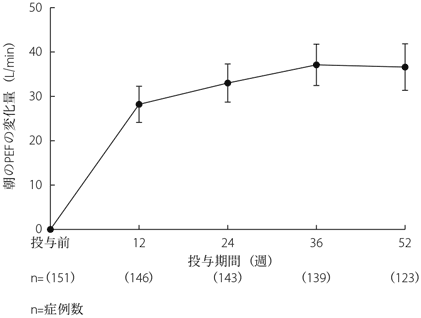
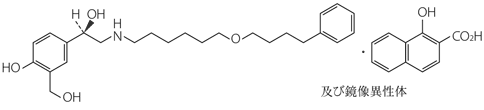
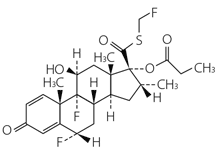
1
Yoshihara S,et al.:Pediatr Allergy Immunol.2019;30:195–203
2
Calverley PMA,et al.:N Engl J Med.2007;356:775-789
3
Daniel MJ,et al.:基礎と臨床.1992;26:2011-2030
4
Manchee GR,et al.:Drug Metab Dispos.1996;24:555-559
5
Meibohm B,et al.:Rev Contemp Pharmacother.1998;9:535-549
6
足立 満ほか:アレルギー・免疫.2005;12:922-936
7
大田 健ほか:アレルギー・免疫.2007;14:635-647
8
Kavuru M,et al.:J Allergy Clin Immunol.2000;105:1108-1116
9
Shapiro G,et al.:Am J Respir Crit Care Med.2000;161:527-534
10
Aubier M,et al.:Respir Med.1999;93:876-884
11
Bateman ED,et al.:Am J Respir Crit Care Med.2004;170:836-844
12
西間三馨ほか:日本小児アレルギー学会誌.2008;22:293-296
13
西牟田敏之ほか:日本小児アレルギー学会誌.2008;22:379-390
14
Hanania NA,et al.:Chest.2003;124:834-843
15
武田憲三ほか:基礎と臨床.1994;28:1361-1379
16
宮本昭正ほか:臨床医薬.1993(2002年改訂);9(Suppl.4):23-48
17
宮本昭正ほか:臨床医薬.1993(2002年改訂);9(Suppl.4):219-241
18
川合 満ほか:臨床医薬.2003;19:497-506
19
甲斐広文ほか:応用薬理.1993;45:119-124
20
Phillipps GH.:Respir Med.1990;84(Suppl.A):19-23
21
藤原 肇ほか:基礎と臨床.1992;26:1271-1295