1
社内報告: 薬物動態(妊娠ラット、妊娠ウサギ). 2007.(2007年4月18日承認、CTD2.6.4.4.3、2.6.4.6.6)
2
社内報告: 生殖発生毒性(ラット、ウサギ). 2007.(2007年4月18日承認、CTD2.6.6.6)
3
深瀬広幸.: 薬理と治療. 2006; 34(11): 1191-9.
4
深瀬広幸.: 薬理と治療. 2006; 34(11): 1201-8.
5
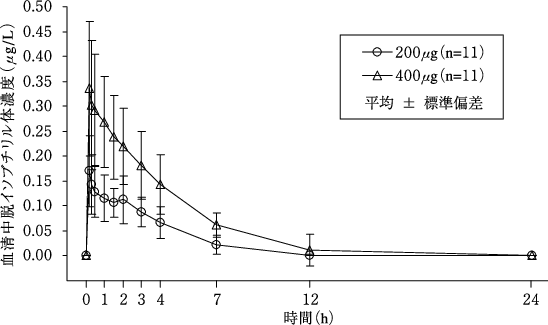
Nave R, et al.: Clin Pharmacokinet. 2004; 43(7): 479-86.
6
Leach CL, et al.: J Aerosol Med. 2006; 19(2): 117-26.
7
Newman S, et al.: Respir Med. 2006; 100(3): 375-84.
8
Rohatagi S, et al.: Am J Ther. 2005; 12(3): 201-9.
9
Nave R, et al.: Biopharm Drug Dispos. 2006; 27(4): 197-207.
10
社内報告: 代謝(ラット肺組織). 2007.(2007年4月18日承認、CTD2.6.4.5.1)
11
社内報告: 代謝(ヒト肝細胞、肝ミクロソーム). 2007.(2007年4月18日承認、CTD2.7.2.2.2)
12
Peet CF, et al.: Eur J Drug Metab Pharmacokinet. 2005; 30(4): 275-86.
13
社内報告: 排泄(健康成人). 2007.(2007年4月18日承認、CTD2.7.1.2.1.2)
14
社内報告: 薬物動態(肝機能障害患者). 2007.(2007年4月18日承認、CTD2.7.2.2.5.2)
15
社内報告: 薬物動態(小児気管支喘息患者). 2010.(2011年1月21日承認、CTD2.7.2.2.1)
16
社内報告: 薬物動態(健康高齢者). 2007.(2007年4月18日承認、CTD2.7.2.2.5.1)
17
社内報告: 薬物動態(健康成人、CYP3A4阻害剤併用). 2007.(2007年4月18日承認、CTD2.7.2.2.5.4)
18
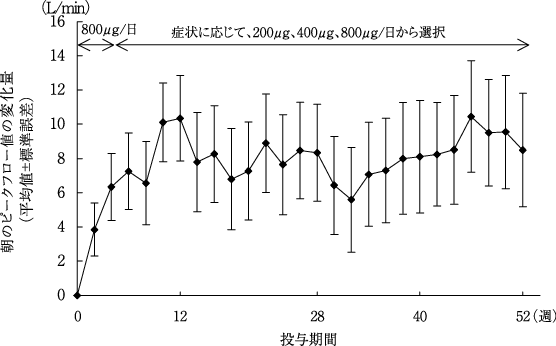
社内報告: プラセボとの二重盲検比較試験(気管支喘息患者). 2007.(2007年4月18日承認、CTD2.7.3.2)
19
社内報告: 対照薬との非盲検比較試験(気管支喘息患者). 2007.(2007年4月18日承認、CTD2.7.3.2)
20
Adachi M, et al.: Ther Res. 2008; 29(5): 821-32.
21
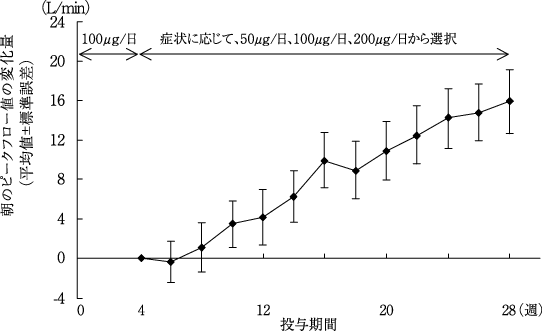
社内報告: 用量確認試験(小児気管支喘息患者). 2010.(2011年1月21日承認、CTD2.7.3.2.1)
22
社内報告: 長期投与試験(小児気管支喘息患者). 2010.(2011年1月21日承認、CTD2.7.3.2.2)
23
Stoeck M, et al.: J Pharmacol Exp Ther. 2004; 309(1): 249-58.
24
社内報告: 喘息抑制作用(卵白アルブミン感作ラット). 2007.(2007年4月18日承認、CTD2.6.2.2.2)
25
Kanniess F, et al.: Pulm Pharmacol Ther. 2001; 14(2): 141-7.
26
社内報告: 血清コルチゾール及びオステオカルシン濃度への影響(気管支喘息患者). 2007.(2007年4月18日承認、CTD5.3.5.1.2)