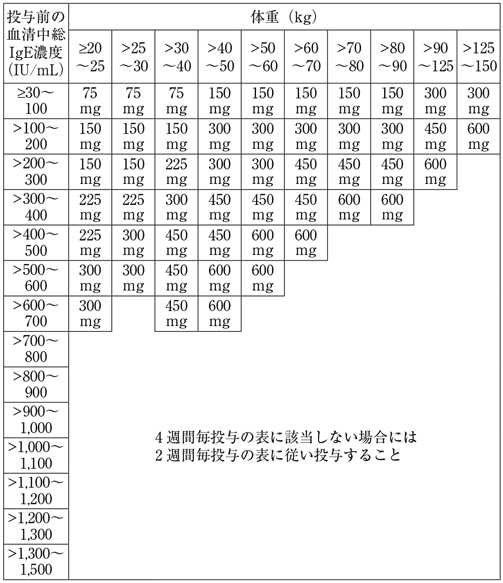
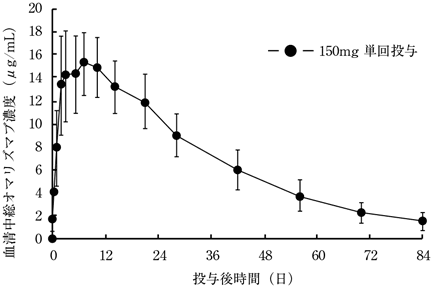
1
Limb, SL. et al.: J Allergy Clin. Immunol. 2007;120(6):1378-1381 [20090675]
2
Lieberman, PL. et al.: J Allergy Clin Immunol. 2017;140(6):1734-1736.e4. [20210080]
3
社内資料:薬物動態試験 [20090677]
4
社内資料:母集団薬物動態/薬力学解析(2013年8月20日承認、CTD2.7.2.3) [20133898]
5
Ohta, K. et al.: Respirology 2009;14(8):1156-1165 [20100362]
6
Humbert, M. et al.: Allergy 2005;60(3):309-316 [20083599]
7
社内資料:喘息患者を対象とした国内小児臨床試験(B1301試験)(2013年8月20日承認、CTD2.7.6-4.2.1) [20133996]
8
Lanier, B. et al.: J Allergy Clin. Immunol. 2009;124(6):1210-1216 [20132382]
9
社内資料:喘息患者を対象とした海外小児臨床試験(IA05試験)(2013年8月20日承認、CTD2.7.6-4.1.1) [20133997]
10
社内資料:スギ花粉症患者を対象とした国内臨床試験(F1301試験)(2019年12月11日承認、CTD2.7.6-4.1.1) [20190555]
11
社内資料:特発性の慢性蕁麻疹患者を対象とした国際共同試験(E2306試験)(2017年3月24日承認、CTD2.7.6-4.1.1) [20170085]
12
社内資料:薬理試験(阻害様式)(2009年1月21日承認、CTD2.6.2-2.4.3) [20090915]
13
社内資料:薬理試験(ヒスタミン遊離に対する効果及びFcεRI結合IgEへの影響) [20090916]
14
Fahy, J. V. et al.: Am. J. Respir. Crit. Care Med. 1997;155(6):1828-1834 [20083589]
15
Zielen, S. et al.: Int Arch Allergy Immunol 2013;160(1):102-110 [20132833]
16
Boulet, L. P. et al.: Am. J. Respir. Crit. Care Med. 1997;155(6):1835-1840 [20083590]