1
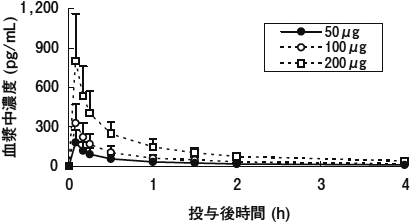
社内資料:日本人及び白人健康成人を対象とした単回投与試験(2012年9月28日承認、CTD2.7.2-2.1.1)[20124339]
2
社内資料:外国人慢性閉塞性肺疾患患者を対象とした反復投与試験(2012年9月28日承認、CTD2.7.2-2.2.1)[20124345]
3
社内資料:吸入投与時のバイオアベイラビリティの評価(2012年9月28日承認、CTD2.7.6-1.1.1)[20124340]
4
社内資料:血球移行性及び血漿中蛋白結合率(2012年9月28日承認、CTD2.6.4-4.1)[20124349]
5
社内資料:肝細胞、肝ミクロソーム及び肺ミクロソームでの代謝(2012年9月28日承認、CTD2.6.4-5)[20124350]
6
社内資料:肝細胞での代謝(2012年9月28日承認、CTD2.6.4-5)[20124436]
7
社内資料:小腸ミクロソーム及び小腸S9画分での代謝(2012年9月28日承認、CTD2.6.4-5)[20124437]
8
社内資料:代謝に関わるCYP分子種の同定(2012年9月28日承認、CTD2.6.4-5)[20124351]
9
社内資料:腎機能低下が薬物動態に及ぼす影響(2012年9月28日承認、CTD2.7.2-2.1.2)[20124342]
10
Dumitras S., et al.:Int J Clin Pharmacol Ther. 2013;51(10):771-779[20143374]
11
社内資料:CYP各分子種に対する阻害作用(2012年9月28日承認、CTD2.6.4-7.1)[20124438]
12
社内資料:CYP2B6に対する阻害作用(2012年9月28日承認、CTD2.7.2-3.3.1)[20124354]
13
社内資料:MDR1、MRP2及びBCRPに対する阻害作用(2012年9月28日承認、CTD2.6.4-7.1)[20124353]
14
社内資料:OATP1B1及びOATP1B3に対する阻害作用[20143488]
15
社内資料:OAT1及びOAT3に対する阻害作用[20143489]
16
社内資料:OCT1及びOCT2に対する阻害作用(2012年9月28日承認、CTD2.6.4-7.1)[20124355]
17
社内資料:代謝酵素及びトランスポーターに対する誘導作用(2012年9月28日承認、CTD2.6.4-7.1)[20124352]
18
社内資料:慢性閉塞性肺疾患患者(日本人を含む)を対象とした国際共同第III相臨床試験(2012年9月28日承認、CTD2.7.6-4.1.2)[20124343]
19
社内資料:日本人慢性閉塞性肺疾患患者を対象とした長期投与試験(2012年9月28日承認、CTD2.7.6-4.1.3)[20124344]
20
社内資料:in vitroにおけるムスカリン受容体に対する親和性試験(2012年9月28日承認、CTD2.6.2-2.1)[20124346]
21
Villetti G., et al.:Br. J. Pharmacol. 2006;148(3):291-298[20124439]
22
社内資料:ラットにおけるメサコリン誘発in vivo気管支収縮モデルを用いた気管支収縮抑制効果の検討(2012年9月28日承認、CTD2.6.2-2.3.1.1)[20124347]
23
社内資料:アカゲザルにおけるメサコリン誘発in vivo気道収縮モデルを用いた気道収縮抑制効果の検討(2012年9月28日承認、CTD2.6.2-2.3.1.3)[20124348]





 GPL 50
GPL 50