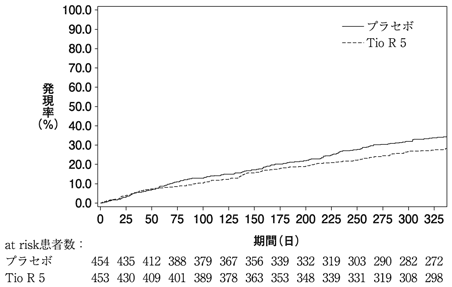
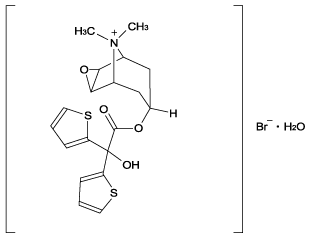
1
社内資料:健康成人での反復投与薬物動態試験(2014年11月18日承認、CTD 2.7.2 1.2)
2
Fukuchi Y et al:社内資料 国内クロスオーバー試験の薬物動態
3
社内資料:健康成人でのバイオアベイラビリティ試験(2014年11月18日承認、CTD 2.7.2 1.2)
4
社内資料:薬物動態試験併合解析(2014年11月18日承認、CTD 2.7.2 1.2)
5
社内資料:薬物動態試験(分布:血漿蛋白結合)(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.2.5)
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.2.5)
6
社内資料:非臨床薬物動態試験(分布:全身オートラジオグラフィ)(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.2.1)
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.2.1)
7
社内資料:非臨床薬物動態試験(分布:組織内分布)(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.2.2)
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.2.2)
8
社内資料:非臨床薬物動態試験(排泄:乳汁中移行)(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.4.3)
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.4.3)
9
社内資料:非臨床薬物動態試験(代謝:血漿中加水分解)(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.3.2)
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.3.2)
10
社内資料:薬効薬理試験(ヒト ムスカリン受容体への親和性)(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ホ 1.5.7)
スピリーバ吸入用カプセル18μg、申請資料概要ホ 1.5.7)
11
社内資料:薬物動態試験(代謝:肝ミクロソーム)(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.3.2)
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.3.2)
12
社内資料:薬物動態試験(代謝:肝細胞)(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.3.2)
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 2.3.2)
13
社内資料:薬物動態試験(代謝:チトクロームP450阻害)(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 3.8.1)
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 3.8.1)
14
社内資料:高齢者における薬物動態試験(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 3.5)
スピリーバ吸入用カプセル18μg、申請資料概要ヘ 3.5)
15
Puyal C et al:社内資料 用量反応試験
16
Tuerck D et al:J Clin Pharmacol.2004;44:163-72
17
社内資料:海外1年間投与二重盲検比較試験(205.117試験)(2014年11月18日承認、CTD 2.7.2 1.2)
18
Ichinose M et al:Respir Med.2010;104:228-36
19
Towse LJ et al:社内資料 海外1年間投与二重盲検比較試験(205.254試験)
20
Towse LJ et al:社内資料 海外1年間投与二重盲検比較試験(205.255試験)
21
Towse LJ et al:社内資料 海外1年間投与二重盲検比較試験の併合データ
22
Van Andel A E et al:社内資料 海外12週間投与二重盲検比較試験(205.251試験)
23
Van Andel A E et al:社内資料 海外12週間投与二重盲検比較試験(205.252試験)
24
社内資料:48週間投与国際共同二重盲検比較試験(205.416試験)(2014年11月18日承認、CTD 2.7.6 1.5)
25
社内資料:48週間投与国際共同二重盲検比較試験(205.417試験)(2014年11月18日承認、CTD 2.7.6,1.6)
26
社内資料:48週間投与国際共同二重盲検比較試験(205.416/205.417試験)(2014年11月18日承認、CTD 2.7.6 1.7)
27
社内資料:24週間投与国際共同二重盲検比較試験(205.418試験)(2014年11月18日承認、CTD 2.7.6 1.8)
28
社内資料:24週間投与国際共同二重盲検比較試験(205.419試験)(2014年11月18日承認、CTD 2.7.6 1.9)
29
社内資料:国内長期投与試験(205.464試験)(2014年11月18日承認、CTD 2.7.6 1.12)
30
社内資料:海外12週間投与二重盲検比較試験(205.442試験)(2014年11月18日承認、CTD 2.7.6 1.11)
31
Takahashi T et al: Am J Respir Crit Care Med.1994;150(6):1640-45
32
社内資料 薬効薬理試験(ヒト ムスカリン受容体サブタイプからの解離)(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ホ 1.5.2)
スピリーバ吸入用カプセル18μg、申請資料概要ホ 1.5.2)
33
社内資料:薬効薬理試験(抗コリン作用(モルモット))(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ホ 1.1.4)
スピリーバ吸入用カプセル18μg、申請資料概要ホ 1.1.4)
34
社内資料:薬効薬理試験(抗コリン作用(ウサギ、イヌ)など)(2004年10月22日承認臭化チオトロピウム水和物
スピリーバ吸入用カプセル18μg、申請資料概要ホ 1.1.3)
スピリーバ吸入用カプセル18μg、申請資料概要ホ 1.1.3)
35
大村剛史ほか: 医学と薬学.2004;51(5):711-6