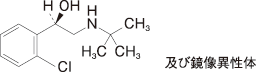1
Uematsu T,et al.:Eur J Clin Pharmacol. 1993;44:361-364
2
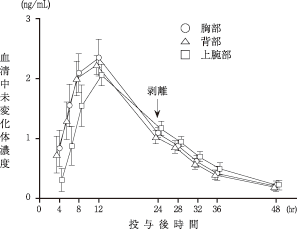
社内資料:経皮吸収型気管支拡張剤HN-078の貼付部位に関する検討試験(承認年月日:1998.9.30)
3
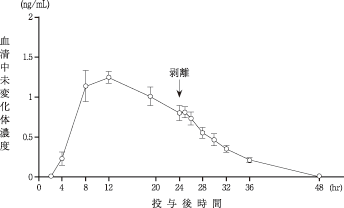
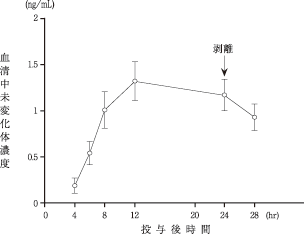
社内資料:経皮吸収型気管支拡張剤HN-078の臨床第I相試験(血中濃度)(承認年月日:1998.9.30)
4
飯倉洋治ほか:医療. 1994;48(3):190-195
5
村田光夫ほか:薬物動態. 1996;11(6):634-641
6
村田光夫ほか:薬物動態. 1996;11(6):614-626
7
社内資料:ヒトにおける蛋白結合率(承認年月日:1998.9.30、申請資料概要IX.6)
8
社内資料:経皮吸収型気管支拡張剤HN-078の臨床第I相試験(代謝)(承認年月日:1998.9.30)
9
社内資料:経皮吸収型気管支拡張剤HN-078の臨床第I相試験(尿中排泄)(承認年月日:1998.9.30)
10
宮本昭正ほか:臨床医薬. 1995;11(4):761-782
11
宮本昭正ほか:臨床医薬. 1995;11(4):783-807
12
馬場実ほか:小児科診療. 1995;58(7):1316-1333
13
三浦傅ほか:新薬と臨牀. 1995;44(4):589-601
14
石岡伸一ほか:Therapeutic Research. 1995;16(5):1449-1462
15
石岡伸一ほか:診療と新薬. 1995;32(4):834-842
16
崎山幸雄ほか:小児科臨床. 1995;48(6):1351-1362
17
垣内正人ほか:薬理と治療. 1996;24(4):779-788
18
Kubo S,et al.:Arzneimittelforschung. 1975;25(7):1028-1037