1
慶松元興ほか: 新薬と臨牀. 2014; 63(12): 1964-1980
2
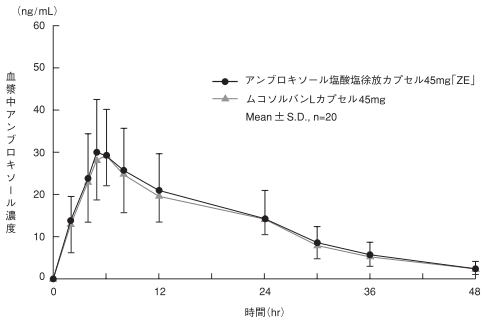
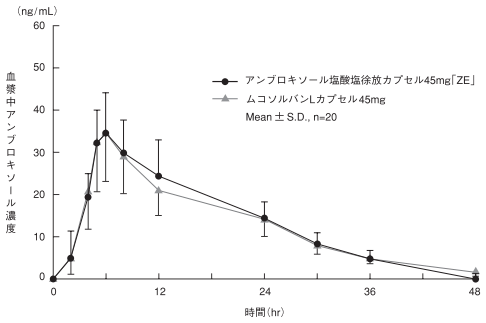
社内資料: 生物学的同等性試験
3
長岡 滋ほか: Therapeutic Research. 1993; 14(2): 617-646
4
長岡 滋ほか: 薬理と治療. 1981; 9(5): 1845-1854
5
千田勝一ほか: 薬理と治療. 1981; 9(2): 483-486
6
前多治雄ほか: 薬理と治療. 1981; 9(2): 487-490
7
Curti PC: Pneumonologie. 1972; 147(1): 62-74
8
Curti PC, et al.: Arzneim-Forsch. 1978; 28(5a): 922-925




 0120-189-228
0120-189-228

