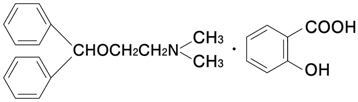
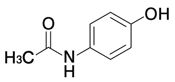
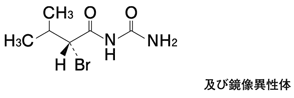
1
社内資料:カフコデN配合錠の薬物動態試験
2
柏木征三郎ほか:臨牀と研究. 1993;70(1):240-260
3
第十八改正 日本薬局方解説書. 廣川書店. 2021:C-2297-2300
4
第十八改正 日本薬局方解説書. 廣川書店. 2021:C-5661-5665
5
第十八改正 日本薬局方解説書. 廣川書店. 2021:C-146-150
6
第十八改正 日本薬局方解説書. 廣川書店. 2021:C-5140-5143
7
社内資料:カフコデN配合錠の鎮咳効果の比較試験
8
勝山巖:基礎と臨床. 1993;27(1):149-155
9
勝山巖:基礎と臨床. 1993;27(1):157-166
10
社内資料:カフコデN配合錠の鎮痛効果の比較試験
11
勝山巖:基礎と臨床. 1993;27(1):167-185