1
Bruderer S, et al.:Pharmacology. 2013;91(5-6):331-338
2
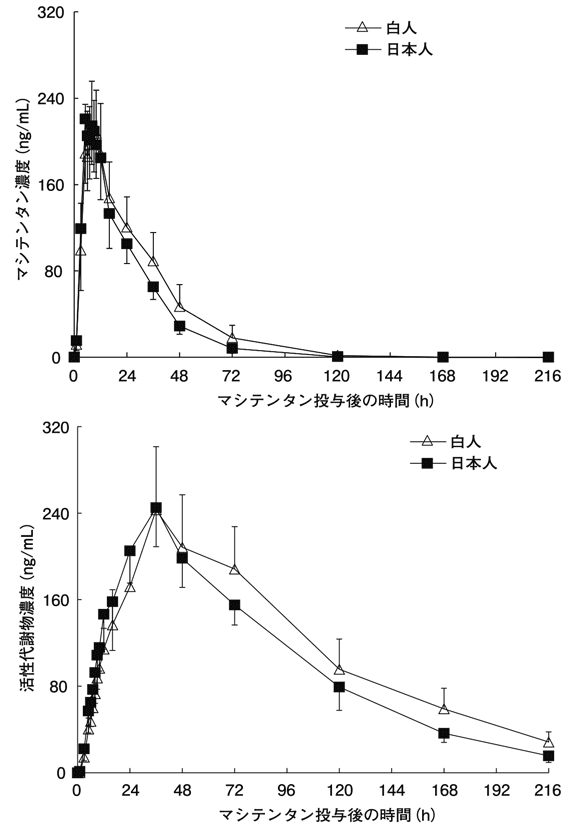
社内資料:日本人健康成人男性を対象とした薬物動態試験(2015年3月26日承認、CTD2.7.6.2)
3
社内資料:肺動脈性肺高血圧症患者を対象とした継続投与試験(2015年3月26日承認、CTD2.7.6.2)
4
社内資料:日本人肺動脈性肺高血圧症患者を対象とした第Ⅱ/Ⅲ相試験(2015年3月26日承認、CTD2.7.6.2)
5
Tahara N, et al.:Circ J. 2016;80:1478-1483
6
社内資料:健康成人男性を対象とした食事の影響の検討(2015年3月26日承認、CTD2.7.6.2)
7
社内資料:血漿タンパク結合及び赤血球中への移行の検討(2015年3月26日承認、CTD2.7.2.3)
8
Bruderer S, et al.:Xenobiotica. 2012;42:901-910
9
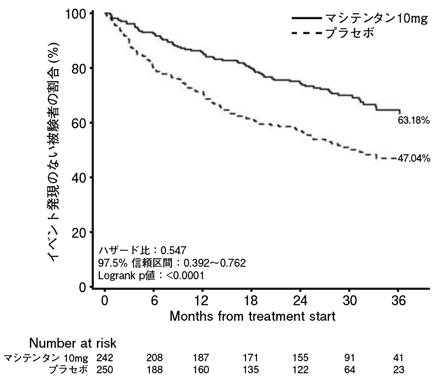
社内資料:肺動脈性肺高血圧症患者を対象とした第Ⅲ相試験(2015年3月26日承認、CTD2.7.6.2)
10
Sidharta PN, et al.:J Clin Pharmacol. 2014;54(3):291-300
11
社内資料:健康成人男性を対象としたワルファリンとの薬物相互作用の検討(2015年3月26日承認、CTD2.7.6.2)
12
社内資料:健康成人男性を対象としたシルデナフィルとの薬物相互作用の検討(2015年3月26日承認、CTD2.7.6.2)
13
Atsmon J, et al.:Clin Pharmacokinet. 2013; 52(8):685-692
14
Bruderer S, et al.:AAPS J. 2012;14:68-78
15
Pulido T, et al. :NEJM. 2013;369:809-818
16
Iglarz M, et al. :JPET. 2008;327:736-745
17
社内資料:ET受容体へのET-1結合試験(2015年3月26日承認、CTD2.6.2.2)
18
社内資料:モノクロタリン誘発肺高血圧ラットモデルを用いた検討(2015年3月26日承認、CTD2.6.2.2)
19
社内資料:高血圧ラットモデルを用いた検討(2015年3月26日承認、CTD2.6.2.2)
20
社内資料:ブレオマイシン誘発肺線維症ラットモデルを用いた検討(2015年3月26日承認、CTD2.6.2.2)