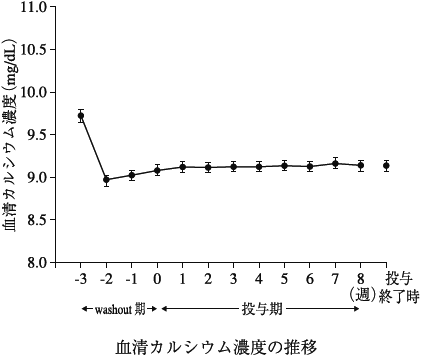
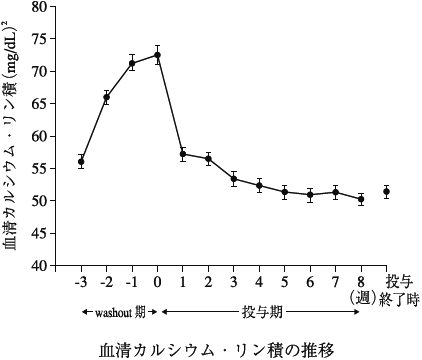
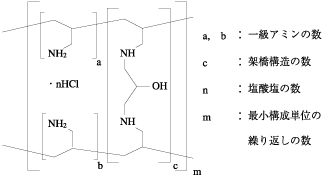
1
Plone M, et al. Clin Pharmacokinet. 2002;41(7):517-23.
2
Burke S, et al. J Clin Pharmacol. 2001;41:199-205.
3
Burke S, et al. J Clin Pharmacol. 2001;41:193-8.
4
Pruchnicki MC, et al. J Clin Pharmacol. 2002;42:1171-6.
5
鈴木正司, 他. 腎と透析. 2003;55(2):383-400.
6
平松信, 他. 腎と透析. 2003;55(4):653-63.
7
大森浩之, 他. 腎と透析. 2003;55(3):513-31.
8
永野伸郎, 他. 日本透析医学会雑誌. 2003;36(1):47-54.
9
アデニン誘発腎不全ラットにおける薬理作用(2003年1月31日承認、申請資料概要ホ-2)
10
Nagano N, et al. Nephron. 2001;89(3):321-8.
11
Nagano N, et al. Nephrol Dial Transplant. 2003;18(Suppl 3):iii81-5.
12
Nagano N, et al. Nephrol Dial Transplant. 2001;16(9):1870-8.
13
Katsumata K, et al. Kidney Int. 2003;64(2):441-50.
14
草野健一郎, 他. 薬理と治療. 2003;31(3):203-7.