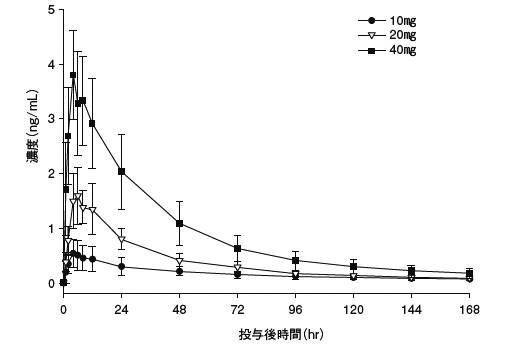
1
社内資料:BMS-96039ラット経口投与による胚・胎児発生に関する試験(2016年9月28日承認、CTD2.6.6.6.2.2)
2
社内資料:BMS-97008妊娠フェレットにおける17日間経口投与試験(2016年9月28日承認、CTD2.6.6.6.2.6)
3
社内資料:AEGR-733PC0031幼若ラットにおける90日間経口投与試験(2016年9月28日承認、CTD2.6.6.6.4.2)
4
社内資料:AEGR-733PC0003マウス104週間経口投与がん原性試験(2016年9月28日承認、CTD2.6.6.5.1.1)
5
社内資料:AEGR-733PC0002ラット104週間経口投与がん原性試験(2016年9月28日承認、CTD2.6.6.5.1.2)
6
社内資料:高コレステロール血症被験者を対象とした第I相試験(2016年9月28日承認、CTD2.7.2.2.3.1)
7
社内資料:CV145-003バイオアベイラビリティ試験(2016年9月28日承認、CTD2.7.2.2.3.4)
8
社内資料:BMS-910060036血漿蛋白結合試験(2016年9月28日承認、CTD2.6.4.4.2)
9
社内資料:AEGR-733PC0009肝細胞を用いた代謝試験(2016年9月28日承認、CTD2.6.4.5.4)
10
社内資料:AEGR-733-010経口投与時の代謝試験(2016年9月28日承認、CTD2.7.2.2.4.2)
11
社内資料:AEGR-733-017肝機能障害を有する被験者における安全性及び薬物動態(2016年9月28日承認、CTD2.7.2.2.5.1)
12
社内資料:AEGR-733-021腎機能障害を有する被験者における安全性及び薬物動態(2016年9月28日承認、CTD2.7.2.2.5.2)
13
社内資料:p-gpとの薬物相互作用試験(2016年9月28日承認、CTD2.7.2.2.1.10)
14
社内資料:AEGR-733PC0021代謝物のP-450の阻害作用(2016年9月28日承認、CTD2.7.2.2.1.8)
15
社内資料:AEGR-733-018ケトコナゾールとの薬物相互作用(2016年9月28日承認、CTD2.7.2.2.6.4)
16
社内資料:AEGR-733-024アトルバスタチンとの薬物相互作用(2016年9月28日承認、CTD2.7.2.2.6.6)
17
社内資料:AEGR-733-029エストラジオール/ノルゲスチメート合剤との薬物相互作用(2016年9月28日承認、CTD2.7.2.2.6.7)
18
社内資料:AEGR-733-101モダフィニルとの薬物相互作用(2016年9月28日承認、CTD2.7.2.2.6.8)
19
社内資料:AEGR-733-002薬物相互作用(2016年9月28日承認、CTD2.7.2.2.6.1)
20
社内資料:AEGR-733-013ワルファリンとの薬物相互作用(2016年9月28日承認、CTD2.7.2.2.6.2)
21
社内資料:AEGR-733-030国内臨床試験(2016年9月28日承認、CTD2.7.6.32)
22
社内資料:UP1002/AEGR-733-005海外臨床試験(2016年9月28日承認、CTD2.7.6.21)