1
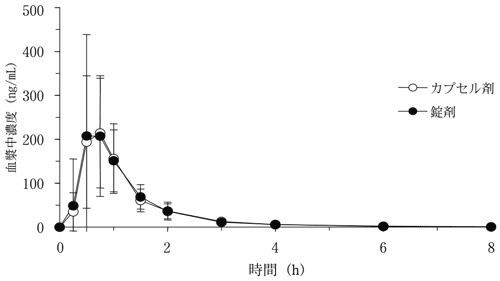
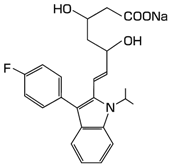
社内資料:フルバスタチン30mgの錠剤とカプセル剤の生物学的同等性試験
2
増田直記ほか:臨床医薬 11(suppl. 1), 65, 1995
3
Fischer, V. et al.:Drug Metab. Dispo. 27(3), 410, 1999
4
Tse, F. L. S. et al.:J. Clin. Pharmacol. 32(7), 630, 1992
5
寺本民生ほか:臨床医薬 11(suppl. 1), 181, 1995
6
寺本民生ほか:臨床医薬 11(suppl. 1), 235, 1995
7
中谷矩章ほか:臨床医薬 11(suppl. 1), 213, 1995
8
中谷矩章ほか:臨床医薬 11(8), 1679, 1995
9
橋本俊雄ほか:臨床医薬 11(suppl. 2), 29, 1995
10
梶山梧朗ほか:臨床医薬 11(suppl. 1), 267, 1995
11
山本田力也ほか:臨床医薬 11(3), 651, 1995
12
井藤英喜ほか:臨床医薬 11(suppl. 2), 45, 1995
13
小堀祥三ほか:臨床医薬 11(suppl. 2), 95, 1995
14
外山淳治ほか:臨床医薬 11(suppl. 2), 153, 1995
15
杉本恒明ほか:臨床医薬 11(suppl. 2), 171, 1995
16
Yamamoto, A. et al.:Experientia 51(3), 223, 1995
17
Hayashi, K. et al.:Biochim. Biophys. Acta 1167(2), 223, 1993
18
Kurokawa, J. et al.:Biochim. Biophys. Acta 1259(1), 99, 1995
19
Shiomi, M. et al.:Arzneim. -Forsch. Drug Res. 44(10), 1154, 1994