1
Keech,A.et al.:Lancet.2005;366:1849-1861
2
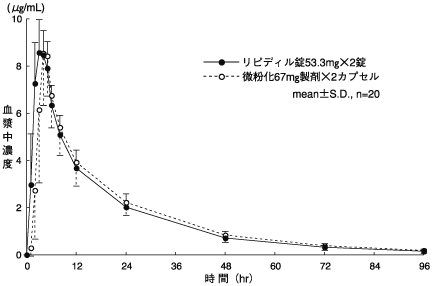
社内資料:薬物動態比較試験、健康成人、フェノフィブラート53.3mg錠と微粉化フェノフィブラート67mgカプセル
3
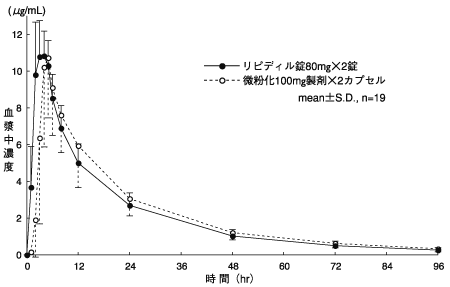
社内資料:薬物動態比較試験、健康成人、フェノフィブラート80mg錠と微粉化フェノフィブラート100mgカプセル
4
社内資料:食事の影響に関する試験、健康成人、フェノフィブラート80mg錠
5
社内資料:蛋白結合率、健康成人、フェノフィブラートカプセル製剤
6
社内資料:代謝、健康成人、フェノフィブラートカプセル製剤
7
社内資料:排泄、健康成人、微粉化フェノフィブラートカプセル製剤
8
Brodie,R.R.et al.:Arzneim.-Forsch.(Drug Res.).1976;26(5):896-901
9
中谷矩章他:薬理と治療.1995;23(6):1617-1626
10
社内資料:フェノフィブリン酸のCYP阻害試験
11
馬渕 宏他:臨床評価.1995;23(2):247-305
12
秦 葭哉他:Geriat.Med.1995;33(6):765-822
13
板倉弘重他:Prog.Med.1997;17(3):635-659
14
五島雄一郎他:Geriat.Med.1995;33(7):909-938
15
馬渕 宏他:Prog.Med.1995;15(Suppl.1):1047-1067
16
藤島正敏他:Prog.Med.1995;15(Suppl.1):1069-1086
17
鹿住 敏他:臨床評価.1995;23(3):523-551
18
赤岡家雄他:Prog.Med.1995;15(Suppl.1):1088-1109
19
Schoonjans,K.et al.:EMBO J.1996;15(19):5336-5348
20
Staels,B.et al.:J.Clin.Invest.1995;95(2):705-712
21
Schoonjans,K.et al.:J.Lipid Res.1996;37(5):907-925
22
荒川礼二郎他:薬理と治療.1995;23(Suppl.4):S1055-1061
23
永山 隆他:薬理と治療.1995;23(Suppl.4):S1071-1082
24
永山 隆他:薬理と治療.1995;23(Suppl.4):S1063-1070
25
Vu-Dac,N.et al.:J.Biol.Chem.1994;269(49):31012-31018
26
Vu-Dac,N.et al.:J.Clin.Invest.1995;96(2):741-750
27
佐々木淳他:臨床評価.1995;23(3):553-579
28
土屋亜紀子他:薬理と治療.1995;23(Suppl.4):S1041-1046
29
永山 隆他:薬理と治療.1995;23(Suppl.4):S1047-1054