1
キョーリンリメディオ株式会社社内資料:
ベニジピン塩酸塩錠2mg「杏林」・4mg「杏林」・8mg「杏林」の生物学的同等性試験に関する資料
ベニジピン塩酸塩錠2mg「杏林」・4mg「杏林」・8mg「杏林」の生物学的同等性試験に関する資料
2
Karasawa A, et al.:Jan J Pharmacol. 1988; 47: 35-44
3
Ishii A, et al.:J Cardiovasc Pharmacol. 1993; 21: 191-196
有効成分 | 日局ベニジピン塩酸塩 2mg |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、ヒドロキシプロピルセルロース、カルメロースカルシウム、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール4000、酸化チタン、黄色三二酸化鉄、カルナウバロウ |
有効成分 | 日局ベニジピン塩酸塩4 mg |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、ポリビニルアルコール(部分けん化物)、ステアリン酸マグネシウム、ヒドロキシプロピルセルロース、マクロゴール6000、タルク、酸化チタン、黄色三二酸化鉄 |
有効成分 | 日局ベニジピン塩酸塩 8mg |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、ヒドロキシプロピルセルロース、カルメロースカルシウム、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール4000、酸化チタン、黄色三二酸化鉄、カルナウバロウ |
| 剤形 | フィルム コーティング錠 |
|---|---|
| 色調 | 黄色 |
| 外形 |  |
| 大きさ | 大きさ(直径) 6.1mm 大きさ(厚さ) 2.8mm |
| 質量 | 83mg |
| 識別コード | KRM113 |
| 剤形 | 割線入りフィルム コーティング錠 |
|---|---|
| 色調 | 黄色 |
| 外形 |  |
| 大きさ | 大きさ(直径) 7.1mm 大きさ(厚さ) 3.2mm |
| 質量 | 126mg |
| 識別コード | PH733 |
| 剤形 | 割線入りフィルム コーティング錠 |
|---|---|
| 色調 | 黄色 |
| 外形 |  |
| 大きさ | 大きさ(直径) 8.6mm 大きさ(厚さ) 3.9mm |
| 質量 | 248mg |
| 識別コード | KRM114 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
降圧作用を有する薬剤 | 血圧が過度に低下することがある。 | 降圧作用が増強される。 |
ジゴキシン | ジギタリス中毒があらわれるおそれがある。 ジゴキシンの血中濃度と心臓の状態をモニターし、異常が認められた場合には、ジゴキシンの用量の調節又は本剤の投与を中止する。 | カルシウム拮抗剤が、ジゴキシンの尿細管分泌を阻害し、血中ジゴキシン濃度を上昇させるとの報告がある。 |
シメチジン | 血圧が過度に低下するおそれがある。 | シメチジンが肝ミクロソームにおけるカルシウム拮抗剤の代謝酵素を阻害する一方で胃酸を低下させ、薬物の吸収を増加させるとの報告がある。 |
リファンピシン | 降圧作用が減弱されるおそれがある。 | リファンピシンが肝の薬物代謝酵素を誘導し、カルシウム拮抗剤の代謝を促進し、血中濃度を低下させるとの報告がある。 |
イトラコナゾール | 血圧が過度に低下することがある。 | イトラコナゾールが、肝臓における本剤の代謝を阻害し、本剤の血中濃度が上昇するおそれがある。 |
グレープフルーツジュース | 血圧が過度に低下することがある。 | グレープフルーツジュースが、肝臓における本剤の代謝を阻害し、本剤の血中濃度が上昇する。 |
0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|
肝臓 | 肝機能異常(AST,ALT,γ-GTP,ビリルビン,Al-P,LDH上昇等) | ||
腎臓 | BUN上昇、クレアチニン上昇 | ||
血液 | 白血球減少、好酸球増加 | 血小板減少 | |
循環器 | 動悸、顔面紅潮、ほてり、血圧低下 | 胸部重圧感、徐脈、頻脈 | 期外収縮 |
精神神経系 | 頭痛、頭重、めまい、ふらつき、立ちくらみ | 眠気、しびれ感 | |
消化器 | 便秘 | 腹部不快感、嘔気、胸やけ、口渇 | 下痢、嘔吐 |
過敏症 | 発疹 | そう痒感 | 光線過敏症 |
口腔 | 歯肉肥厚 | ||
その他 | 浮腫(顔・下腿・手)、CK上昇 | 耳鳴、手指の発赤・熱感、肩こり、咳嗽、頻尿、倦怠感、カリウム上昇 | 女性化乳房、結膜充血、霧視、発汗 |
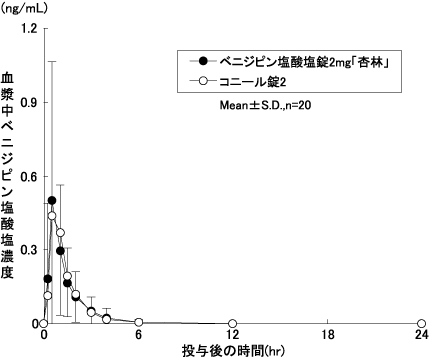
判定パラメータ | ||
AUC0-24 (ng・hr/mL) | Cmax (ng/mL) | |
ベニジピン塩酸塩 錠2mg「杏林」 | 0.649 ±0.616 | 0.598 ±0.535 |
コニール錠2 | 0.656 ±0.727 | 0.570 ±0.592 |
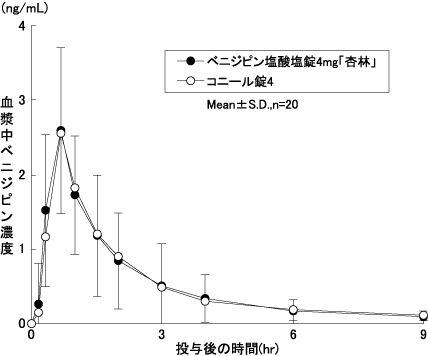
判定パラメータ | ||
AUC0-24 (ng・hr/mL) | Cmax (ng/mL) | |
ベニジピン塩酸塩 錠4mg「杏林」 | 4.834 ±2.429 | 2.875 ±1.007 |
コニール錠4 | 4.759 ±1.566 | 2.862 ±1.088 |