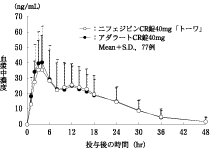
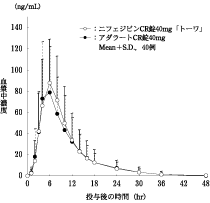
1
中道昇他:薬理と治療.1995;23(Suppl.2):s241-s255
2
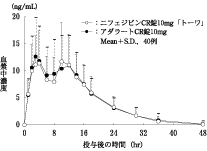
40mg 1日1回投与で効果不十分な高血圧症患者を対象とした臨床薬理試験(アダラートCR錠:2013年6月14日承認、審査報告書)
3
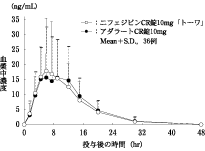
池西康晴他:医学と薬学.2005;54(2):181-187
4
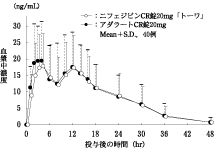
社内資料:生物学的同等性試験(CR錠10mg)
5
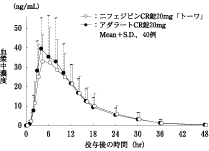
保田国伸他:医学と薬学.2004;51(6):907-913
6
社内資料:生物学的同等性試験(CR錠20mg)
7
社内資料:生物学的同等性試験(CR錠40mg)
8
Duhm B,et al.:Arzneim.-Forsch./Drug Res.1972;22(1):42-53
9
島本和明他:薬理と治療.1995;23(Suppl.2):s407-s422
10
藤島正敏他:臨牀と研究.1995;72(1):174-190
11
Liu Y,et al.:Int'l J.Clin.Pharmacol.Ther.2017;55(3):246-255
12
石井當男他:薬理と治療.1997;25(7):1817-1828
13
石井當男他:薬理と治療.1997;25(7):1829-1838
14
石井當男他:薬理と治療.1997;25(7):1869-1902
15
石井當男他:薬理と治療.1997;25(7):1839-1868
16
猿田享男他:薬理と治療.1997;25(7):1917-1941
17
柊山幸志郎他:薬理と治療.1997;25(7):1903-1915
18
Shimamoto K.et al.:Hypertens.Res.2014;37(1):69-75
19
長期継続投与試験(アダラートCR錠:2013年6月14日承認、審査報告書)
20
長期継続投与試験(アダラートCR錠:2013年6月14日承認、審査報告書)
21
Shimamoto K.et al.:Hypertens.Res.2015;38(10):695-700
22
加藤和三他:薬理と治療.1995;23(Suppl.2):s449-s463
23
加藤和三他:薬理と治療.1995;23(Suppl.2):s465-s477
24
加藤和三他:薬理と治療.1997;25(7):1943-1973
25
加藤和三他:薬理と治療.1997;25(7):1975-2005
26
Hayase S,et al.:Jpn.Circulation J.1971;35(8):903-914
27
Fleckenstein A.et al.:Arzneim.-Forsch./Drug Res.1972;22(1):22-33
28
橋本虎六他:心臓.1971;3(11):1294-1304
29
Kanazawa T,et al.:Arzneim.-Forsch./Drug Res.1974;24(9):1267-1274
30
Taira N.et al.:5th International Adalat® Symposium.Excerpta Medica.1983:17-25
31
Vater W.:2nd International Adalat® Symposium. Springer.1975;77-81
32
Nayler WG,et al.:Am.J.Cardiol.1980;46(2):242-248
33
Fleckenstein A,et al.:5th International Adalat® Symposium.Excerpta Medica.1983;36-52
34
Kazda S,et al.:5th International Adalat® Symposium.Excerpta Medica.1983;133-143
35
Pumphrey CW,et al.:Am.J.Cardiol.1983;51(3):591-595
36
Taira N,et al.:2nd International Adalat® Symposium.Springer.1975;40-48