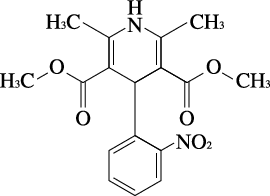
1
Bursztyn, M. et al.:Arch. Intern. Med. 1986;146:397
2
Elkayam, U. et al.:Circulation. 1990;82:1954-1961
3
Kleinbloesem, C.H. et al.:Clin. Phrmacol. Ther. 1986;40:21-28
4
Zenarola, P. et al.:Dermatologica. 1991;182:196-198
5
Furberg, C.D. et al.:Circulation. 1995;92:1326-1331
6
Pahor, M. et al.:J. Am. Geriatr. Soc. 1995;43:1191-1197
7
社内資料:薬物動態
8
Muller-Enoch, D.:Arzneim.-Forsch./Drug Res. 1999;49:470-475
9
中村仁 他:呼吸と循環 1983;31:549-561
10
荒川正昭 他:臨床と研究 1982;59:1334-1346
11
斉藤博 他:臨床成人病 1982;12:2421-2426
12
本岡龍彦 他:診療と新薬 1981;18:1655-1667
13
河合忠一 他:臨床と研究 1981;58:989-998
14
豊嶋英明 他:治療 1981;63:2349-2355
15
鈴木典夫 他:臨床と研究 1982;59:2022-2028
16
Ishii, H. et al.:Eur. J. Pharmacol. 1980;64:21-29
17
Morita, T. et al.:Arzneim.-Forsch./Drug Res. 1982;32:1047-1052
18
Kubo, T. et al.:J. Pharmacobio-Dyn. 1981;4:294-300
19
川崎武 他:医学と薬学 1981;6:1339-1352
20
森田富範 他:基礎と臨床 1979;13:2879-2882
21
森田富範 他:基礎と臨床 1978;12:3041-3046
22
Morita, T. et al.:Arzneim.-Forsch./Drug Res. 1982;32:1053-1056