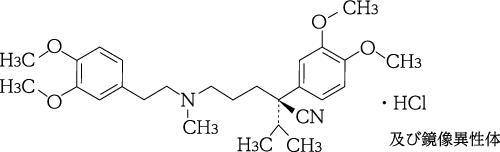
1
Kroemer, H.K. et al.:Naunyn-Schmiedebergs Arch. Pharmacol. 1993;348(3):332-337
2
木川田隆一 他:臨牀と研究. 1975;52(3):880-884
3
石川兵衞 他:臨牀と研究. 1976;53(5):1409-1413
4
柏木政伸 他:臨牀と研究. 1976;53(11):3489-3493
5
Fleckenstein, A. et al.:Naunyn-Schmiedebergs Arch. Pharmacol. 1969;264(3):227-228
6
Narimatsu, A. et al.:Naunyn-Schmiedebergs Arch. Pharmacol. 1976;294(2):169-177
7
古谷幸雄 他:麻酔. 1983;32(4):409-417
8
Fleckenstein, A. et al.:Arzneim. Forsch. 1970;20(9a):1317-1322
9
Nabata, H.:Jpn. J. Pharmacol. 1977;27(2):239-249
10
Okada, T. et al.:Jpn. Circ.J. 1975;39(8):913-917
11
池田信男 他:臨牀と研究. 1977;54(12):4176-4180
12
Motomura, S. et al.:Naunyn-Schmiedebergs Arch. Pharmacol. 1981;315(3):241-248