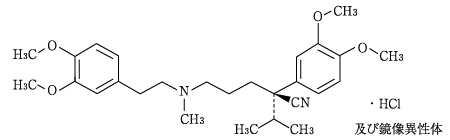
1
Kroemer H.K. et al.:Naunyn-Schmiedebergs Arch. Pharmacol., 1993;348(3):332-337
2
Fleckenstein A. et al.:Naunyn-Schmiedebergs Arch. Pharmacol., 1969;264(3):227-228
Ca++拮抗性不整脈・虚血性心疾患治療剤
1錠 6.4円
有効成分 | 1錠中:ベラパミル塩酸塩 40mg |
|---|---|
添加剤 | アラビアゴム末、結晶セルロース、酸化チタン、ステアリン酸マグネシウム、ゼラチン、タルク、乳糖水和物、白糖、ヒプロメロース、黄色4号(タートラジン)アルミニウムレーキ |
| 外形 | 表面 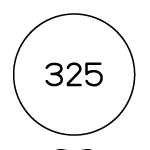 裏面  側面 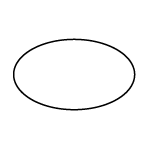 |
|---|---|
| 大きさ | 大きさ(直径) 7.4mm 大きさ(厚さ) 4.4mm |
| 質量 | 185mg |
| 識別コード | t 325 |
| 色・剤形 | 淡黄色の糖衣錠 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
血圧降下剤 | 血圧の低下が増強することがある。 | 本剤と血圧降下剤の血管拡張作用が増強される。 |
β-遮断剤 ラウオルフィア製剤 | 心機能の低下や徐脈があらわれることがある。自覚症状、心電図等に注意し、異常が認められた場合には、本剤又は相手薬剤を減量又は中止するなど適切な処置を行うこと。 | 本剤は陰性変力作用や房室結節、洞結節を抑制する作用を有し、両者の心抑制作用が相互に増強される。特にジギタリス製剤との3剤併用時には注意すること。 |
抗不整脈剤 キニジン硫酸塩水和物 プロカインアミド塩酸塩 リドカイン ピルシカイニド塩酸塩水和物 フレカイニド酢酸塩等 低カリウム血症を起こすおそれがある薬剤 利尿剤等 | 徐脈、房室ブロックがあらわれることがあり、高度の不整脈に発展させることがある。自覚症状、心電図等に注意し、異常が認められた場合には、本剤又は相手薬剤を減量又は中止すること。 | 相加的な抗不整脈作用の増強や低カリウム血症により催不整脈作用が生じる。 |
ジギタリス製剤 ジゴキシン メチルジゴキシン等 | 高度の徐脈、房室ブロック等の徐脈性不整脈があらわれることがある。また、これらの不整脈を含めたジギタリスの血中濃度上昇による中毒症状(悪心・嘔吐、食欲不振、頭痛、疲労、倦怠感等)があらわれることがある。定期的に心電図検査を行い、ジギタリスの中毒症状の有無を確認し、必要に応じてジギタリスの血中濃度を測定する。異常が認められた場合には、両剤を減量又は中止するなど適切な処置を行うこと。 | 相加的な房室結節・洞結節抑制作用の増強やジギタリスの心刺激作用により不整脈が生じる。特にβ-遮断剤との3剤併用時には注意すること。 また、ジギタリスの血中濃度の上昇は本剤のジギタリスの腎排泄抑制によるものと考えられる。 |
ダビガトランエテキシラートメタンスルホン酸塩 | ダビガトランの抗凝固作用が増強することがあるので、ダビガトランエテキシラートの用量調節や投与間隔を考慮するなど、投与方法に十分注意すること。 | ダビガトランの血中濃度を上昇させる。 |
吸入麻酔薬 | 心機能の低下や徐脈があらわれることがある。脈拍数、心電図等に注意し、異常が認められた場合には、適切な処置を行うこと。 | 本剤は陰性変力作用や房室結節、洞結節を抑制する作用を有し、両剤の心抑制作用が相互に増強される。 |
リトナビル | 本剤のAUCが3倍を超えることが予測されるので、本剤を減量するとともに血中濃度のモニターや診察の回数を増やすなど慎重に投与すること。 | 相手薬剤によるチトクロームP450(CYP3A4)に対する競合的阻害作用により、本剤の血中濃度を上昇させる。 |
インジナビル硫酸塩エタノール付加物 アタザナビル硫酸塩 キヌプリスチン・ダルホプリスチン | 本剤の血中濃度が上昇し、副作用を増強するおそれがある。 | 相手薬剤によるチトクロームP450(CYP3A4)に対する競合的阻害作用により、本剤の血中濃度を上昇させる。 |
イトラコナゾール ミコナゾール | 本剤の血中濃度を上昇させることがある。 | 相手薬剤のチトクロームP450(CYP3A4)の阻害作用により、本剤の代謝が阻害され、血中濃度を上昇させる。 |
アプリンジン塩酸塩 | アプリンジンの血中濃度が上昇することがある。異常が認められた場合には、アプリンジンを減量又は中止するなど適切な処置を行うこと。 | 本剤によるチトクロームP450(CYP3A4)に対する競合的阻害作用により、相手薬剤の血中濃度を上昇させる。 |
カルバマゼピン | カルバマゼピンの血中濃度が上昇し、中毒症状(めまい、頭痛等)があらわれることがある。カルバマゼピンの血中濃度に注意し、異常が認められた場合には、適切な処置を行うこと。 | 本剤によるチトクロームP450(CYP3A4)に対する競合的阻害作用により、相手薬剤の血中濃度を上昇させる。 |
ミダゾラム | ミダゾラムの血中濃度が上昇することがある。異常が認められた場合には、適切な処置を行うこと。 | 本剤によるチトクロームP450(CYP3A4)に対する競合的阻害作用により、相手薬剤の血中濃度を上昇させる。 |
セレギリン塩酸塩 | セレギリンの作用を増強し、毒性が大幅に増強する可能性がある。 | 本剤によるチトクロームP450(CYP3A4)に対する競合的阻害作用により、相手薬剤の血中濃度を上昇させる。 |
シクロスポリン | シクロスポリンの血中濃度が上昇することがある。シクロスポリンの血中濃度に注意し、異常が認められた場合には、シクロスポリンを減量又は中止すること。 | 本剤によるチトクロームP450(CYP3A4)に対する競合的阻害作用により、相手薬剤の血中濃度を上昇させる。 |
パクリタキセル | パクリタキセルの血中濃度が上昇することがある。異常が認められた場合には、パクリタキセルを減量、投与間隔を延長又は中止するなど適切な処置を行うこと。 | 本剤によるチトクロームP450(CYP3A4)に対する競合的阻害作用により、相手薬剤の血中濃度を上昇させる。 |
ビノレルビン酒石酸塩 | ビノレルビンの血中濃度が上昇することがある。 | 本剤によるチトクロームP450(CYP3A4)に対する競合的阻害作用により、相手薬剤の血中濃度を上昇させる。 |
ゲフィチニブ | ゲフィチニブの血中濃度が上昇し、副作用を増強するおそれがある。 | 本剤によるチトクロームP450(CYP3A4)に対する競合的阻害作用により、相手薬剤の血中濃度を上昇させる。 |
エレトリプタン臭化水素酸塩 | エレトリプタンの血中濃度が上昇することがある。 | 本剤によるチトクロームP450(CYP3A4)に対する競合的阻害作用により、相手薬剤の血中濃度を上昇させる。 |
テオフィリン アミノフィリン水和物 コリンテオフィリン | テオフィリンの血中濃度が上昇することがある。テオフィリンの血中濃度に注意し、異常が認められた場合には、テオフィリン製剤を減量又は中止するなど適切な処置を行うこと。 | 本剤による肝薬物代謝酵素阻害作用により、テオフィリンのクリアランスが低下するため、テオフィリンの血中濃度を上昇させる。 |
リファンピシン フェニトイン フェノバルビタール | 本剤の作用が減弱することがある。 | 相手薬剤のチトクロームP450(CYP3A4)の誘導作用により、本剤の血中濃度を低下させる。 |
ダントロレンナトリウム | 高カリウム血症や心機能低下が生じることがある。 | 機序は不明である。 |
グレープフルーツジュース | 本剤の血中濃度を上昇させることがある。異常が認められた場合には、本剤を減量するなど適切な処置を行うこと。また、グレープフルーツジュースとの同時服用をしないよう注意すること。 | グレープフルーツジュースに含まれる成分のチトクロームP450(CYP3A4)の阻害作用により、本剤の血中濃度を上昇させる。 |
0.1~5%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|
循環器 | 房室伝導時間の延長、頭痛、めまい、血圧低下 | ||
過敏症 | 発疹 | ||
消化器 | 便秘、悪心・嘔吐 | 食欲不振 | |
口腔 | 歯肉肥厚 | ||
肝臓 | AST、ALTの上昇等 | ||
内分泌 | 血中プロラクチンの上昇、男性における血中黄体形成ホルモン・血中テストステロンの低下、女性型乳房 | ||
その他 | 浮腫 |