1
阿部真也ほか: 周産期医学. 2017; 47: 1353-1355
2
齊藤大祐ほか: 鹿児島産科婦人科学会雑誌. 2021; 29: 49-54
3
堀本政夫ほか: 応用薬理. 1991; 42(2): 167-176
4
Naito T., et al.: J. Hum. Lact. 2015; 31(2): 301-306
5
Laine K., et al.: Br. J. Clin. Pharmacol. 1997; 43: 29-33
6
社内資料: 健康成人における生物学的同等性試験(2012年9月28日承認、CTD2.7.6.2)
7
社内資料: 食事による薬物動態への影響(2012年9月28日承認、CTD2.7.6.1)
8
社内資料: ヒト肝ミクロソームを用いたイルベサルタンの酸化代謝におけるCYP2C9の関与
9
社内資料: イルベサルタンのグルクロン酸抱合の種差
10
社内資料: ヒト肝ミクロソームを用いたイルベサルタンのCYP阻害の検討
11
社内資料: イルベサルタンのバイオアベイラビリティ試験
12
中島光好ほか: 臨床医薬. 1991; 7(7): 1407-1435
13
Beresford A. P., et al.: Xenobiotica. 1988; 18(2): 245-254
14
社内資料: 腎機能障害患者におけるイルベサルタンの薬物動態試験
15
社内資料: 肝硬変患者におけるイルベサルタンの薬物動態試験
16
足立幸彦ほか: 薬理と治療. 1991; 19(7): 2923-2932
17
社内資料: 高齢者におけるイルベサルタンの薬物動態試験
18
桑島巌ほか: 老年医学. 1991; 29(6): 899-902
19
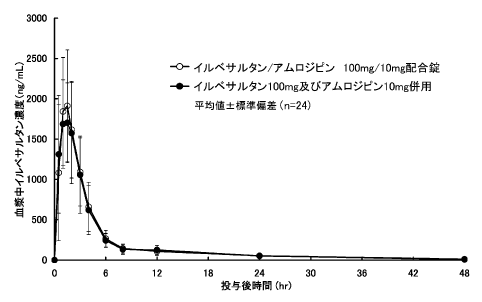
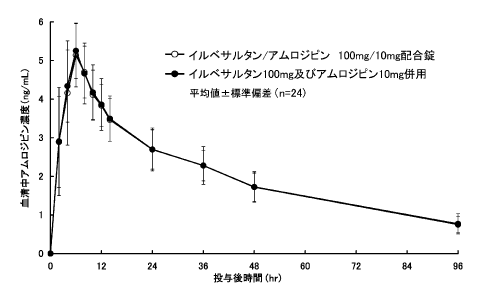
社内資料: イルベサルタンとアムロジピンの併用単回投与時における薬物相互作用試験
20
島田和幸ほか: 血圧. 2011; 18(12): 1231-1243
21
島田和幸ほか: 血圧. 2012; 19(11): 1022-1034
22
社内資料: イルベサルタンのウサギ摘出大動脈における作用
23
社内資料: イルベサルタンのAⅡ誘発昇圧反応に対する作用
24
社内資料: イルベサルタンのAⅡ受容体に対する拮抗様式の検討
25
社内資料: イルベサルタンのAⅡ受容体サブタイプに対する選択性
26
社内資料: イルベサルタンの各種受容体及びイオン輸送系に対する作用
27
社内資料: イルベサルタンの各種酵素に対する作用
28
山中教造ほか: 日薬理誌. 1991; 97: 167-178
29
社内資料: 高血圧自然発症ラットの血圧に対する作用(2012年9月28日承認、CTD2.6.2.2)