1
阿部真也ほか:周産期医学. 2017;47:1353-1355(L20230078)
2
齊藤大祐ほか:鹿児島産科婦人科学会雑誌. 2021;29:49-54(L20230079)
3
Naito T et al.:J Hum Lact. 2015;31(2):301-306(L20200668)
4
Stangier J et al.:J Clin Pharmacol. 2000;40:1373-1379(L20200249)
5
Makani H et al.:BMJ. 2013;346:f360(L20200250)
6
Laine K et al.:Br J Clin Pharmacol. 1997;43(1):29-33(L20200670)
7
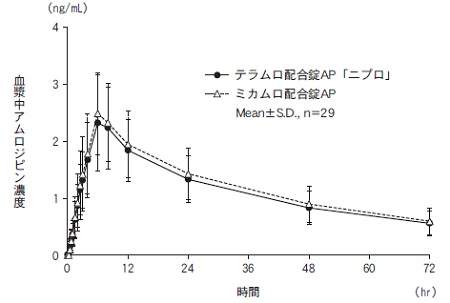
社内資料:生物学的同等性試験(配合錠AP)
8
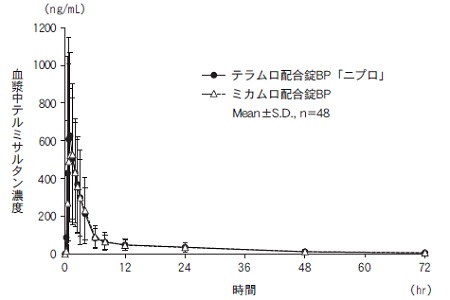
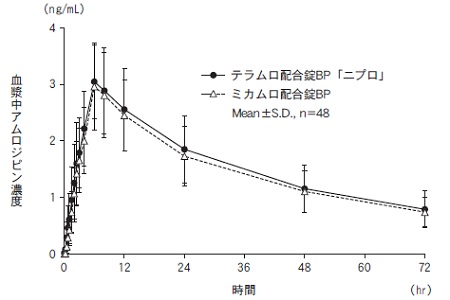
社内資料:生物学的同等性試験(配合錠BP)
9
食事の影響試験(ミカムロ配合錠AP:2010年7月23日承認、CTD2.7.6.1.3、2.7.1)(L20230951)
10
代謝(ミカルディスカプセル:2002年10月8日承認、申請資料概要へ.2.(5))(L20230952)
11
Beresford A P et al.:Xenobiotica. 1988;18(2):245-254(L20200673)
12
肝機能障害患者における薬物動態試験(ミカルディスカプセル:2002年10月8日承認、申請資料概要ヘ.3.(4))(L20230017)
13
足立幸彦ほか:薬理と治療. 1991;19(7):2923-2932(L20200674)
14
Wienen W:Br J Pharmacol. 1993;110(1):245-252(L20200262)
15
Wienen W:Cardiovascular Drug Reviews. 2000;18(2):127-156(L20200263)
16
Yamada S et al.:J Cardiovasc Pharmacol. 1994;23(3):466-472(L20200719)
17
山中教造ほか:日本薬理学雑誌. 1991;97(3):167-178(L20200689)
18
Burges R A et al.:J Cardiovasc Pharmacol. 1987;9(1):110-119(L20200721)