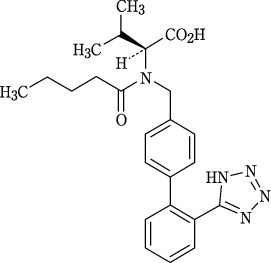
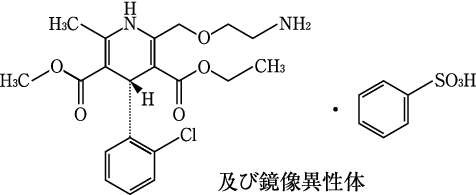
1
Sheps S G, et al.:Arch Intern Med. 1997;157(21):2413-2446
2
阿部真也ほか:周産期医学 2017;47:1353-1355
3
齊藤大祐ほか:鹿児島産科婦人科学会雑誌 2021;29:49-54
4
Briggs G G, et al.:Ann Pharmacother. 2001;35(7-8):859-861
5
Cooper W O, et al.:N Engl J Med. 2006;354(23):2443-2451
6
Naito T, et al.:J Human Lactation. 2015;31(2):301-306
7
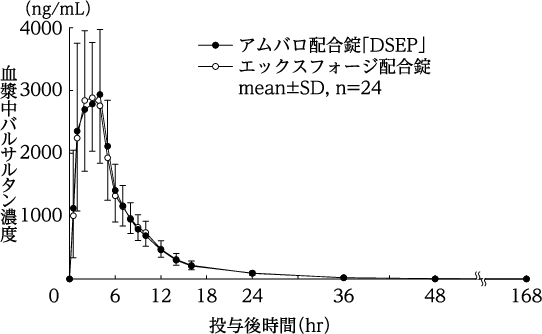
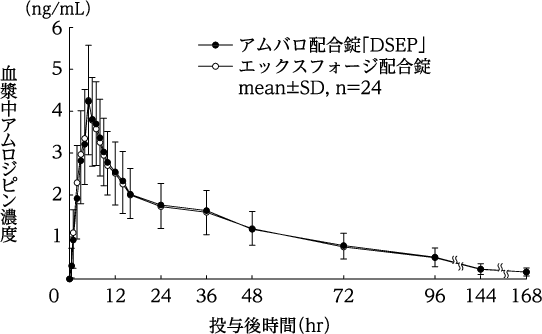
配合剤投与時と併用投与時の生物学的同等性の検討(エックスフォージ配合錠:2010年1月20日承認、CTD2.7.6.1.2.3)
8
社内資料:生物学的同等性に関する資料
9
薬物動態に及ぼす食事の影響の検討(エックスフォージ配合錠:2010年1月20日承認、CTD2.7.6.1.1.1)
10
Colussi D M, et al.:J Clin Pharmacol. 1997;37(3):214-221
11
Meredith P A, et al.:Clin Pharmacokinet. 1992;22(1):22-31
12
Waldmeier F, et al.:Xenobiotica. 1997;27(1):59-71
13
Nakashima A, et al.:Xenobiotica. 2005;35(6):589-602
14
Guengerich F P, et al.:J Med Chem. 1991;34(6):1838-1844
15
Beresford A P, et al.:Xenobiotica. 1988;18(2):245-254
16
バルサルタンとアムロジピンの薬物間相互作用の検討(エックスフォージ配合錠:2010年1月20日承認、CTD2.7.6.3.1.1)
17
荻原俊男ほか:血圧 2010;17(4):314-328
18
国内第Ⅲ相試験:1301試験(エックスフォージ配合錠:2010年1月20日承認、CTD2.7.6.5.1.1)
19
本態性高血圧症に対する長期試験(エックスフォージ配合錠:2010年1月20日承認、CTD2.7.6.5.2.1)
20
緒言(エックスフォージ配合錠:2010年1月20日承認、CTD2.6.1.1)
21
効力を裏付ける試験(エックスフォージ配合錠:2010年1月20日承認、CTD2.6.2.6.1)
22
高血圧自然発症ラットの血圧に対する作用(経口投与試験)(エックスフォージ配合錠:2010年1月20日承認、CTD2.6.2.2.1.1.2)