1
阿部真也ほか:周産期医学 2017;47:1353-1355
2
齊藤大祐ほか:鹿児島産科婦人科学会雑誌 2021;29:49-54
3
Stangier J, et al.:J Clin Pharmacol. 2000;40:1373-1379
4
Makani H, et al.:BMJ. 2013;346:f360
5
Rai A, et al. Am J Respir Crit Care Med. 2016;193:A1890
6
Jansson PS, et al. J Emerg Med. 2018;55:836-840
7
Vadas P. Am J Emerg Med. 2020;38:1299.e1-2
8
Kane SP, et al. Perfusion. 2018;33:320-322
9
Pottegard A, et al.:J Intern Med. 2017;282(4):322-331
10
Pedersen SA, et al.:J Am Acad Dermatol. 2018;78(4):673-681
11
社内資料:生物学的同等性試験
12
社内資料:生物学的同等性試験
13
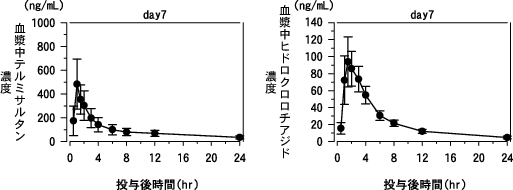
社内資料:健康成人での薬物動態試験(ミコンビ配合錠:2009年4月22日承認、CTD2.7.2.2)
14
Young CL, et al.:J Clin Pharmacol. 2000;40(12 Pt 1):1323-1330.
15
Beerman B, et al.:Clin Pharmacol Ther. 1976;19(5)Part1:531-537.
16
社内資料:食事の影響試験(ミコンビ配合錠:2009年4月22日承認、CTD2.7.6.1)
17
社内資料:血漿蛋白結合率試験(ミカルディスカプセル:2002年10月8日承認、申請資料概要 添付資料ヘ-17~20)
18
社内資料:血漿蛋白結合率試験(ミカルディスカプセル:2002年10月8日承認、申請資料概要 添付資料ヘ-17~20)
19
社内資料:血漿蛋白結合率試験(ミカルディスカプセル:2002年10月8日承認、申請資料概要 添付資料ヘ-17~20)
20
Stangier J, et al.:J Clin Pharmacol. 2000;40(12 Pt 1):1312-1322.
21
荻原俊男ほか:薬理と治療 2002;30(Suppl.1):S7-S32.
22
社内資料:肝機能障害患者の薬物動態試験(ミコンビ配合錠:2009年4月22日承認、CTD2.7.3.4)
23
社内資料:用量比検討試験(ミコンビ配合錠:2009年4月22日承認、CTD2.7.6.3)
24
社内資料:検証試験(ミコンビ配合錠:2009年4月22日承認、CTD2.7.6.3)
25
社内資料:長期投与試験(ミコンビ配合錠:2009年4月22日承認、CTD2.7.3.4、2.7.6.3)
26
Wienen W.:Br J Pharmacol. 1993;110(1):245-252.
27
Wienen W.:Cardiovascular Drug Reviews. 2000;18(2):127-154
28
第十七改正日本薬局方解説書. 2016;C-4141-4145
29
社内資料:薬効薬理試験(ミコンビ配合錠:2009年4月22日承認、CTD2.6.2.2)
30
社内資料:薬効薬理試験(ミコンビ配合錠:2009年4月22日承認、CTD2.6.2.2)