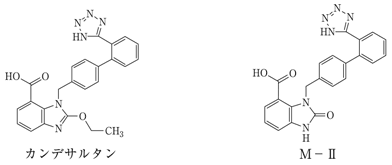
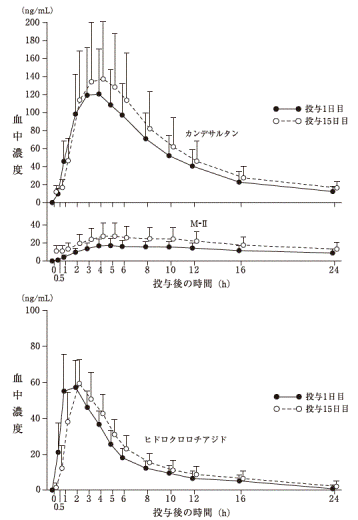
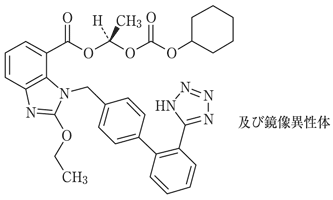
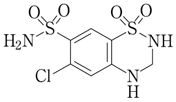
1
阿部真也 他:周産期医学. 2017;47:1353-1355
2
齊藤大祐 他:鹿児島産科婦人科学会雑誌. 2021;29:49-54
3
Rai A. et al.:Am J Respir Crit Care Med. 2016;193:A1890
4
Jansson P.S. et al.:J Emerg Med. 2018;55:836-840
5
Vadas P.:Am J Emerg Med. 2020;38:1299.e1-e2
6
Kane S.P. et al.:Perfusion. 2018;33:320-322
7
Pottegard A. et al.:J.Intern.Med. 2017;282:322-331
8
Pedersen S.A. et al.:J.Am.Acad.Dermatol. 2018;78:673-681
9
野田昌邦 他:薬理と治療. 1996;24:2215-2220
10
柴生田由美子 他:薬理と治療. 1996;24:2207-2213
11
Wada T. et al.:Eur.J.Pharmacol. 1994;253:27-34
12
Goodman & Gilman Pharmacology 10th edition.
13
鈴木 伸 他:臨床医薬. 1996;12:2413-2428
14
青井 渉:臨床医薬. 1996;12:2429-2441
15
藤島正敏 他:臨床医薬. 1996;12:3333-3352
16
荒川規矩男 他:臨床医薬. 1996;12:2195-2211
17
荒川正昭 他:臨床医薬. 1996;12:2267-2296




 293
293
 294
294