1
阿部真也ほか:周産期医学 2017;47:1353-1355
2
齊藤大祐ほか:鹿児島産科婦人科学会雑誌 2021;29:49-54
3
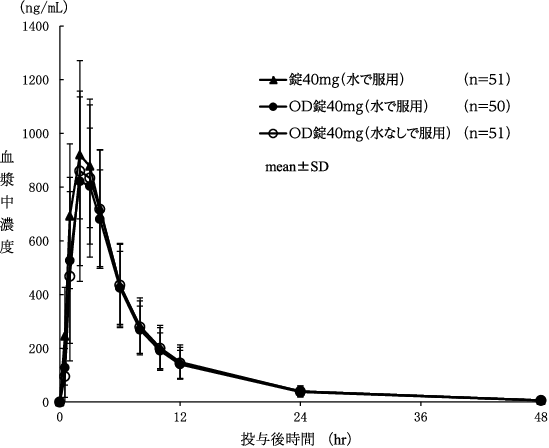
社内資料:日本人健康成人男性を対象としたオルメテック錠40mgと口腔内崩壊錠の生物学的同等性試験
4
田中孝典ほか:臨床医薬 2003;19(10):1131-1142
5
田中孝典ほか:臨床医薬 2003;19(10):1143-1156
6
田中孝典ほか:臨床医薬 2003;19(11):1283-1295
7
von Bergmann K, et al.:J Hypertens. 2001;19(S1):S33-S40
8
田中孝典ほか:臨床医薬 2003;19(11):1297-1306
9
小池博之ほか:三共研究所年報 2003;55:1-91