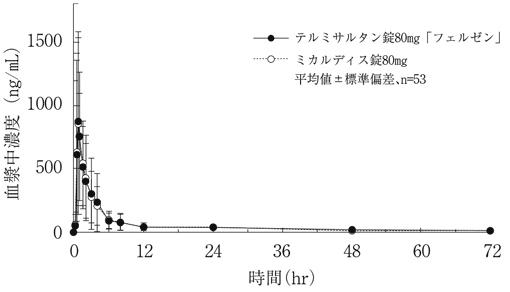
1
阿部真也ほか:周産期医学.2017;47:1353-1355
2
齊藤大祐ほか:鹿児島産科婦人科学会雑誌.2021;29:49-54
3
Stangier J, et al.:J Clin Pharmacol.2000;40:1373-1379
4
Makani H et al.:BMJ.2013;346:f360
5
荻原俊男ほか:薬理と治療.2002;30(Suppl. 1):S271-S283
6
荻原俊男ほか:薬理と治療.2002;30(Suppl. 1):S7-S32
7
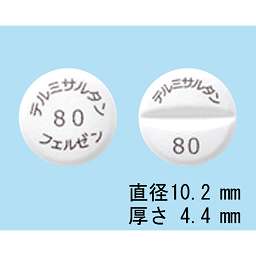
健康成人での薬物動態試験(血漿中濃度)(ミカルディスカプセル:2002年10月8日承認、申請資料概要へ.3.(1).1))
8
第Ⅰ相試験(海外)(ミカルディスカプセル:2002年10月8日承認、申請資料概要ト.4.(1))
9
荻原俊男ほか:薬理と治療.2002;30(Suppl. 1):S235-S251
10
Tatami S et al.:Drug Metab Pharmacokin.2004;19(1):15-23
11
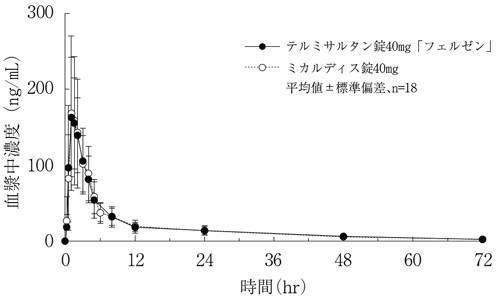
社内資料:生物学的同等性試験(テルミサルタン錠40mg「フェルゼン」)
12
社内資料:生物学的同等性試験(テルミサルタン錠80mg「フェルゼン」)
13
入江伸ほか:薬理と治療.2002;30(Suppl. 1):S201-S208
14
血漿蛋白結合率試験(ミカルディスカプセル:2002年10月8日承認、申請資料概要ヘ.2.(4))
15
Stangier J et al.:J Clin Pharmacol.2000;40:1312-1322
16
健康成人での薬物動態試験(排泄) (ミカルディスカプセル:2002年10月8日承認、申請資料概要ヘ.3.(1).2))
17
荻原俊男ほか:薬理と治療.2002;30(Suppl. 1):S183-S199
18
肝障害患者での薬物動態試験(ミカルディスカプセル:2002年10月8日承認、申請資料概要へ.3.(4))
19
社内資料:生物学的同等性試験(テルミサルタン錠20mg「フェルゼン」)
20
荒川規矩男ほか:薬理と治療.2002;30(9):639-660
21
有効性のまとめ(ミカルディスカプセル:2002年10月8日承認、申請資料概要ト.2.(1))
22
Wienen W.:Br J Pharmacol.1993;110(1):245-252
23
Wienen W.:Cardiovascular Drug Reviews.2000;18(2):127-154
24
薬効薬理試験(高血圧ラット) (ミカルディスカプセル:2002年10月8日承認、申請資料概要ホ.1.(1).1)、ホ.1.(1).3))
25
van Meel JCA:Arzneimittelforschung.1996;46(8):755-759
26
薬効薬理試験(サル降圧作用、作用持続時間) (ミカルディスカプセル:2002年10月8日承認、申請資料概要、添付資料ホ.1.(1).5))
27
薬効薬理試験(正常血圧ラット) (ミカルディスカプセル:2002年10月8日承認、申請資料概要ホ.1.(1).6))
28
Wienen W.:J Renin Angiotensin Aldosterone Syst.2001;2(2):123-128
29
薬効薬理試験(利尿剤との併用効果) (ミカルディスカプセル:2002年10月8日承認、申請資料概要ホ1.(1).8))
30
薬効薬理試験(カルシウム拮抗剤との併用効果) (ミカルディスカプセル:2002年10月8日承認、申請資料概要ホ.1.(1).8))