添付文書番号
2149040F1301_1_10
企業コード
480235
作成又は改訂年月
日本標準商品分類番号
872149
薬効分類名
持続性アンジオテンシンⅡ受容体拮抗剤
承認等
販売名
カンデサルタン錠2mg「トーワ」
販売名コード
販売名英字表記
CANDESARTAN TABLETS 2mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
販売名
カンデサルタン錠4mg「トーワ」
販売名コード
販売名英字表記
CANDESARTAN TABLETS 4mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
販売名
カンデサルタン錠8mg「トーワ」
販売名コード
販売名英字表記
CANDESARTAN TABLETS 8mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
販売名
カンデサルタン錠12mg「トーワ」
販売名コード
販売名英字表記
CANDESARTAN TABLETS 12mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
販売名
カンデサルタンOD錠2mg「トーワ」
販売名コード
販売名英字表記
CANDESARTAN OD TABLETS 2mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
規制区分
販売名
カンデサルタンOD錠4mg「トーワ」
販売名コード
販売名英字表記
CANDESARTAN OD TABLETS 4mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
規制区分
販売名
カンデサルタンOD錠8mg「トーワ」
販売名コード
販売名英字表記
CANDESARTAN OD TABLETS 8mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
規制区分
販売名
カンデサルタンOD錠12mg「トーワ」
販売名コード
販売名英字表記
CANDESARTAN OD TABLETS 12mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
規制区分
一般的名称
カンデサルタン シレキセチル錠/口腔内崩壊錠
禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
妊婦又は妊娠している可能性のある女性
アリスキレンフマル酸塩を投与中の糖尿病患者(ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く)
組成・性状
組成
カンデサルタン錠2mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 カンデサルタン シレキセチル 2mg |
|---|
添加剤 | 乳糖水和物、ヒドロキシプロピルセルロース、クエン酸トリエチル、カルメロースカルシウム、ステアリン酸マグネシウム |
|---|
カンデサルタン錠4mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 カンデサルタン シレキセチル 4mg |
|---|
添加剤 | 乳糖水和物、ヒドロキシプロピルセルロース、クエン酸トリエチル、カルメロースカルシウム、ステアリン酸マグネシウム |
|---|
カンデサルタン錠8mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 カンデサルタン シレキセチル 8mg |
|---|
添加剤 | 乳糖水和物、ヒドロキシプロピルセルロース、クエン酸トリエチル、黄色5号、カルメロースカルシウム、ステアリン酸マグネシウム |
|---|
カンデサルタン錠12mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 カンデサルタン シレキセチル 12mg |
|---|
添加剤 | 乳糖水和物、ヒドロキシプロピルセルロース、クエン酸トリエチル、黄色5号、カルメロースカルシウム、ステアリン酸マグネシウム |
|---|
カンデサルタンOD錠2mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 カンデサルタン シレキセチル 2mg |
|---|
添加剤 | D-マンニトール球状顆粒(100)、D-マンニトール、ヒドロキシプロピルセルロース、ラウリル硫酸ナトリウム、クエン酸トリエチル、アスパルテーム(L-フェニルアラニン化合物)、香料、酸化チタン、ステアリン酸マグネシウム、その他4成分 |
|---|
カンデサルタンOD錠4mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 カンデサルタン シレキセチル 4mg |
|---|
添加剤 | D-マンニトール球状顆粒(100)、D-マンニトール、ヒドロキシプロピルセルロース、ラウリル硫酸ナトリウム、クエン酸トリエチル、アスパルテーム(L-フェニルアラニン化合物)、香料、酸化チタン、ステアリン酸マグネシウム、その他4成分 |
|---|
カンデサルタンOD錠8mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 カンデサルタン シレキセチル 8mg |
|---|
添加剤 | D-マンニトール球状顆粒(100)、D-マンニトール、ヒドロキシプロピルセルロース、ラウリル硫酸ナトリウム、クエン酸トリエチル、アスパルテーム(L-フェニルアラニン化合物)、香料、酸化チタン、ステアリン酸マグネシウム、その他4成分 |
|---|
カンデサルタンOD錠12mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 カンデサルタン シレキセチル 12mg |
|---|
添加剤 | D-マンニトール球状顆粒(100)、D-マンニトール、ヒドロキシプロピルセルロース、ラウリル硫酸ナトリウム、クエン酸トリエチル、アスパルテーム(L-フェニルアラニン化合物)、香料、酸化チタン、ステアリン酸マグネシウム、その他4成分 |
|---|
製剤の性状
カンデサルタン錠2mg「トーワ」
| 剤形 | 素錠 |
|---|
| 色調 | 白色~帯黄白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 5.5mm 大きさ(厚さ) 2.1mm |
|---|
| 質量 | 65mg |
|---|
本体
表示 | 表 カンデサルタン
2 トーワ 裏 カンデサルタン
2 トーワ |
|---|
カンデサルタン錠4mg「トーワ」
| 剤形 | 割線入り素錠 |
|---|
| 色調 | 白色~帯黄白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 7.0mm 大きさ(厚さ) 2.6mm |
|---|
| 質量 | 130mg |
|---|
本体
表示 | 表 カンデ4 裏 カンデ4
サルタン トーワ |
|---|
カンデサルタン錠8mg「トーワ」
| 剤形 | 割線入り素錠 |
|---|
| 色調 | ごくうすいだいだい色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 7.0mm 大きさ(厚さ) 2.6mm |
|---|
| 質量 | 130mg |
|---|
本体
表示 | 表 カンデ8 裏 カンデ8
サルタン トーワ |
|---|
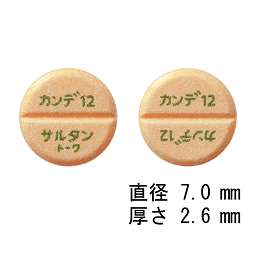
カンデサルタン錠12mg「トーワ」
| 剤形 | 割線入り素錠 |
|---|
| 色調 | うすいだいだい色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 7.0mm 大きさ(厚さ) 2.6mm |
|---|
| 質量 | 130mg |
|---|
本体
表示 | 表 カンデ12 裏 カンデ12
サルタン トーワ |
|---|
カンデサルタンOD錠2mg「トーワ」
| 剤形 | 口腔内崩壊錠 |
|---|
| 色調 | 白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 5.5mm 大きさ(厚さ) 2.5mm |
|---|
| 質量 | 62mg |
|---|
本体
表示 | 表 カンデサルタン
OD 2 トーワ 裏 カンデサルタン
OD 2 トーワ |
|---|
カンデサルタンOD錠4mg「トーワ」
| 剤形 | 割線入りの
口腔内崩壊錠 |
|---|
| 色調 | 白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 7.0mm 大きさ(厚さ) 3.2mm |
|---|
| 質量 | 124mg |
|---|
本体
表示 | 表 カンデ4 裏 カンデサルタン
OD 4 トーワ |
|---|
カンデサルタンOD錠8mg「トーワ」
| 剤形 | 割線入りの口腔内崩壊錠 |
|---|
| 色調 | 白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 8.5mm 大きさ(厚さ) 3.8mm |
|---|
| 質量 | 210mg |
|---|
本体
表示 | 表 カンデ8 裏 カンデサルタン
OD 8 トーワ |
|---|
カンデサルタンOD錠12mg「トーワ」
| 剤形 | 割線入りの口腔内崩壊錠 |
|---|
| 色調 | 白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 9.5mm 大きさ(厚さ) 4.5mm |
|---|
| 質量 | 315mg |
|---|
本体
表示 | 表 カンデ12 裏 カンデサルタン
OD 12 トーワ |
|---|
効能又は効果
〈製剤共通〉
〇高血圧症
〇腎実質性高血圧症
〈錠2mg/4mg/8mg、OD錠2mg/4mg/8mg〉
〇下記の状態で、アンジオテンシン変換酵素阻害剤の投与が適切でない場合
慢性心不全(軽症~中等症)
用法及び用量
〈高血圧症〉
成人
通常、成人には1日1回カンデサルタン シレキセチルとして4~8mgを経口投与し、必要に応じ12mgまで増量する。ただし、腎障害を伴う場合には、1日1回2mgから投与を開始し、必要に応じ8mgまで増量する。
小児
通常、1歳以上6歳未満の小児には1日1回カンデサルタン シレキセチルとして0.05~0.3mg/kgを経口投与する。
通常、6歳以上の小児には1日1回カンデサルタン シレキセチルとして2~8mgを経口投与し、必要に応じ12mgまで増量する。
ただし、腎障害を伴う場合には、低用量から投与を開始し、必要に応じて8mgまで増量する。
〈腎実質性高血圧症〉
通常、成人には1日1回カンデサルタン シレキセチルとして2mgから経口投与を開始し、必要に応じ8mgまで増量する。
〈慢性心不全〉
通常、成人には1日1回カンデサルタン シレキセチルとして4mgから経口投与を開始し、必要に応じ8mgまで増量できる。なお、原則として、アンジオテンシン変換酵素阻害剤以外による基礎治療は継続すること。
用法及び用量に関連する注意
〈高血圧症〉
小児に投与する場合には、成人の用量を超えないこと。
〈慢性心不全〉
投与開始時の収縮期血圧が120mmHg未満の患者、腎障害を伴う患者、利尿剤を併用している患者、心不全の重症度の高い患者には、2mg/日から投与を開始すること。2mg/日投与は、低血圧関連の副作用に対する忍容性を確認する目的であるので4週間を超えて行わないこと。
本剤の投与により、一過性の急激な血圧低下を起こす場合があるので、初回投与時、及び4mg/日、8mg/日への増量時には、血圧等の観察を十分に行うこと。
重要な基本的注意
〈効能共通〉
降圧作用に基づくめまい、ふらつきがあらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
手術前24時間は投与しないことが望ましい。アンジオテンシンⅡ受容体拮抗剤投与中の患者は、麻酔及び手術中にレニン-アンジオテンシン系の抑制作用による高度な血圧低下を起こす可能性がある。
〈慢性心不全〉
通常、ジギタリス製剤、利尿剤等と併用する。なお、本剤の単独投与での有用性は確立していない。
特定の背景を有する患者に関する注意
合併症・既往歴等のある患者
両側性腎動脈狭窄のある患者又は片腎で腎動脈狭窄のある患者
治療上やむを得ないと判断される場合を除き、使用は避けること。腎血流量の減少や糸球体ろ過圧の低下により急速に腎機能を悪化させるおそれがある。
高カリウム血症の患者
治療上やむを得ないと判断される場合を除き、使用は避けること。高カリウム血症を増悪させるおそれがある。
また、腎機能障害、コントロール不良の糖尿病等により血清カリウム値が高くなりやすい患者では、血清カリウム値に注意すること。
厳重な減塩療法中の患者
〈高血圧症〉
少量より開始し、増量する場合は血圧、腎機能及び患者の状態を十分に観察しながら徐々に行うこと。まれに血圧が急激に低下し、ショック、失神、一過性の意識消失や腎機能の低下を起こすおそれがある。
〈慢性心不全〉
血圧、腎機能、貧血の指標(ヘモグロビン等)及び患者の状態を十分に観察しながら投与を開始し、慎重に増量すること。急激な血圧低下、腎機能低下あるいは貧血を起こすおそれがある。
低ナトリウム血症の患者
〈高血圧症〉
少量から開始し、増量する場合は血圧、腎機能及び患者の状態を十分に観察しながら徐々に行うこと。まれに血圧が急激に低下し、ショック、失神、一過性の意識消失や腎機能の低下を起こすおそれがある。
〈慢性心不全〉
血圧、腎機能、貧血の指標(ヘモグロビン等)及び患者の状態を十分に観察しながら投与を開始し、慎重に増量すること。急激な血圧低下、腎機能低下あるいは貧血を起こすおそれがある。
心不全の患者
〈高血圧症〉
少量より開始し、増量する場合は血圧、腎機能及び患者の状態を十分に観察しながら徐々に行うこと。まれに血圧が急激に低下し、ショック、失神、一過性の意識消失や腎機能の低下を起こすおそれがある。
大動脈弁狭窄症又は閉塞性肥大型心筋症のある患者
〈慢性心不全〉
過度の血圧低下を来すと、症状が悪化するおそれがある。
低血圧の患者
〈慢性心不全〉
血圧、腎機能、貧血の指標(ヘモグロビン等)及び患者の状態を十分に観察しながら投与を開始し、慎重に増量すること。急激な血圧低下、腎機能低下あるいは貧血を起こすおそれがある。
NYHA 心機能分類Ⅲ等の比較的重症度の高い慢性心不全患者
〈慢性心不全〉
血圧、腎機能、貧血の指標(ヘモグロビン等)及び患者の状態を十分に観察しながら投与を開始し、慎重に増量すること。急激な血圧低下、腎機能低下あるいは貧血を起こすおそれがある。
薬剤過敏症の既往歴のある患者
腎機能障害患者
腎障害のある患者
〈高血圧症〉
少量より開始し、増量する場合は血圧、腎機能及び患者の状態を十分に観察しながら徐々に行うこと。まれに血圧が急激に低下し、ショック、失神、一過性の意識消失や腎機能の低下を起こすおそれがある。
〈慢性心不全〉
血圧、腎機能、貧血の指標(ヘモグロビン等)及び患者の状態を十分に観察しながら投与を開始し、慎重に増量すること。急激な血圧低下、腎機能低下あるいは貧血を起こすおそれがある。
慢性心不全の臨床試験において、腎障害の合併が腎機能低下発現の要因であった。
血液透析中の患者
〈高血圧症〉
少量より開始し、増量する場合は血圧及び患者の状態を十分に観察しながら徐々に行うこと。まれに血圧が急激に低下し、ショック、失神、一過性の意識消失を起こすおそれがある。
〈慢性心不全〉
血圧、貧血の指標(ヘモグロビン等)及び患者の状態を十分に観察しながら投与を開始し、慎重に増量すること。急激な血圧低下あるいは貧血を起こすおそれがある。
肝機能障害患者
少量から投与を開始するなど慎重に投与すること。肝機能が悪化するおそれがある。また、活性代謝物カンデサルタンのクリアランスが低下することが推定されている。
生殖能を有する者
妊娠する可能性のある女性
妊娠していることが把握されずアンジオテンシン変換酵素阻害剤又はアンジオテンシンⅡ受容体拮抗剤を使用し、胎児・新生児への影響(腎不全、頭蓋・肺・腎の形成不全、死亡等)が認められた例が報告されている,。
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。
本剤投与開始前に妊娠していないことを確認すること。本剤投与中も、妊娠していないことを定期的に確認すること。投与中に妊娠が判明した場合には、直ちに投与を中止すること。
次の事項について、本剤投与開始時に患者に説明すること。また、投与中も必要に応じ説明すること。
妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。投与中に妊娠が判明した場合には、直ちに投与を中止すること。妊娠中期及び末期にアンジオテンシンⅡ受容体拮抗剤又はアンジオテンシン変換酵素阻害剤を投与された患者で羊水過少症、胎児・新生児の死亡、新生児の低血圧、腎不全、高カリウム血症、頭蓋の形成不全及び羊水過少症によると推測される四肢の拘縮、頭蓋顔面の変形、肺の低形成等があらわれたとの報告がある。
授乳婦
授乳しないことが望ましい。ラットの周産期及び授乳期に本剤を強制経口投与すると、10㎎/㎏/日以上の群で出生児に水腎症の発生増加が認められている。なお、ラットの妊娠末期のみ、あるいは授乳期のみに本剤を投与した場合、いずれも300㎎/㎏/日で出生児に水腎症の増加が認められている。
小児等
低出生体重児、新生児又は乳児(1歳未満)を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
糸球体ろ過量(GFR)が30mL/min/1.73m2未満の小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
腎機能及び血清カリウム値を注意深く観察すること。小児等の高血圧では腎機能異常を伴うことが多い。特に、腎機能に影響を及ぼす状態(発熱、脱水)の患者に本剤を投与する場合や血清カリウム値を上昇させる可能性がある他の薬剤と併用する場合は注意すること。
高齢者
一般に過度の降圧は好ましくないとされている。脳梗塞等が起こるおそれがある。
相互作用
併用禁忌(併用しないこと)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
アリスキレンフマル酸塩 ラジレス
(糖尿病患者に使用する場合。ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く。) | 非致死性脳卒中、腎機能障害、高カリウム血症及び低血圧のリスク増加が報告されている。 | レニン-アンジオテンシン系阻害作用が増強される可能性がある。 |
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
カリウム保持性利尿剤 スピロノラクトン
トリアムテレン等 エプレレノン
カリウム補給剤
| 血清カリウム値が上昇することがある。 | 本剤のアルドステロン分泌抑制作用によりカリウム貯留作用が増強することによる。
危険因子:特に腎機能障害のある患者 |
利尿剤 フロセミド
トリクロルメチアジド等 | 利尿剤で治療を受けている患者に本剤を初めて投与する場合、降圧作用が増強するおそれがあるので、少量から開始するなど慎重に投与すること。 | 利尿剤で治療を受けている患者にはレニン活性が亢進している患者が多く、本剤が奏効しやすい。
危険因子:特に最近利尿剤投与を開始した患者 |
アリスキレンフマル酸塩
| 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。eGFRが60mL/min/1.73m2未満の腎機能障害のある患者へのアリスキレンフマル酸塩との併用については、治療上やむを得ないと判断される場合を除き避けること。 | レニン-アンジオテンシン系阻害作用が増強される可能性がある。 |
アンジオテンシン変換酵素阻害剤
| 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。 | レニン-アンジオテンシン系阻害作用が増強される可能性がある。 |
リチウム | リチウム中毒が報告されている。 | 腎尿細管におけるリチウムの再吸収が促進される。 |
次の薬剤により併用治療されている場合 (1)アンジオテンシン変換酵素阻害剤及びβ遮断剤
(2)ループ利尿剤及びカリウム保持性利尿剤 | 慢性心不全の臨床試験では、左記の併用に加え更に本剤を併用すると、立ちくらみ、ふらつき及び低血圧の発現頻度が高く、かつ程度が高い。
腎機能低下あるいは貧血を起こすおそれがある。 | (1)レニン-アンジオテンシン系阻害作用が増強される可能性がある。
(2)利尿剤で治療を受けている患者にはレニン活性が亢進している患者が多く、本剤が奏効しやすい。
危険因子:厳重な減塩療法中の患者、低ナトリウム血症の患者、低血圧の患者、NYHA心機能分類Ⅲ等の比較的重症度の高い慢性心不全患者、腎障害のある患者、血液透析中の患者 |
非ステロイド性消炎鎮痛剤(NSAIDs) インドメタシン等 | 降圧作用が減弱することがある。 | 非ステロイド性消炎鎮痛剤は血管拡張作用を有するプロスタグランジンの合成を阻害することから、降圧作用を減弱させる可能性があると考えられている。 |
非ステロイド性消炎鎮痛剤(NSAIDs) インドメタシン等 | 腎障害のある患者では、さらに腎機能が悪化するおそれがある。 | 非ステロイド性消炎鎮痛剤のプロスタグランジン合成阻害作用により、腎血流量が低下するためと考えられている。 |
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
血管浮腫(頻度不明)
顔面、口唇、舌、咽・喉頭等の腫脹を症状とする血管浮腫があらわれることがある。
ショック(頻度不明)、失神、意識消失(頻度不明。ただし慢性心不全の場合0.1~5%未満)
冷感、嘔吐、意識消失等があらわれた場合には、直ちに適切な処置を行うこと。
急性腎障害(頻度不明。ただし慢性心不全の場合は0.1~5%未満)
高カリウム血症(頻度不明)
肝機能障害、黄疸(頻度不明)
AST、ALT、γ-GTPの上昇等の肝機能障害があらわれることがある。
無顆粒球症(頻度不明)
横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがあるので、このような場合には直ちに投与を中止し、適切な処置を行うこと。
間質性肺炎(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常等を伴う間質性肺炎があらわれることがあるので、このような場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
低血糖(頻度不明)
脱力感、空腹感、冷汗、手の震え、集中力低下、痙攣、意識障害等があらわれた場合には投与を中止すること。糖尿病治療中の患者であらわれやすい。
その他の副作用
| 0.1~5%未満 | 0.1%未満 | 頻度不明 |
|---|
過敏症 | 発疹、湿疹、蕁麻疹、そう痒、光線過敏症 | | |
|---|
循環器 | めまい、ふらつき、立ちくらみ、動悸、ほてり | 期外収縮、心房細動 | |
|---|
精神神経系 | 頭痛、頭重感、不眠、眠気、舌のしびれ感 | 四肢のしびれ感 | |
|---|
消化器 | 悪心、嘔吐、食欲不振、胃部不快感、心窩部痛、下痢、口内炎 | 味覚異常 | |
|---|
肝臓 | AST、ALT、Al-P、LDH、γ-GTPの上昇 | | |
|---|
血液 | 貧血、白血球減少、白血球増多、好酸球増多、血小板減少 | | |
|---|
腎臓 | BUN、クレアチニンの上昇、蛋白尿 | | |
|---|
その他 | 倦怠感、脱力感、鼻出血、頻尿、浮腫、咳、血中カリウム上昇、総コレステロール上昇、血中CK上昇、CRP上昇、血中尿酸上昇、血清総タンパク減少 | 低ナトリウム血症、腰背部痛、筋肉痛 | 耳鳴 |
|---|
〈慢性心不全〉
慢性心不全例では高血圧例に比べ立ちくらみ、ふらつき、低血圧、腎機能異常及び貧血等があらわれやすく、血圧、腎機能及び貧血の指標(ヘモグロビン等)に留意すること。なお、高血圧症の場合の副作用にも注意が必要である。
| 5%以上 | 0.1~5%未満 |
|---|
過敏症 | | 発疹、そう痒 |
|---|
循環器 | 立ちくらみ、低血圧、ふらつき | めまい、徐脈、動悸、期外収縮、ほてり |
|---|
精神神経系 | | 頭痛、眠気、不眠、頭重感、しびれ感 |
|---|
消化器 | | 悪心、心窩部痛、便秘、胃潰瘍、口渇、味覚異常、嘔吐、食欲不振、胃部不快感 |
|---|
肝臓 | γ-GTP上昇 | ALT、AST、LDH、Al-Pの上昇 |
|---|
血液 | 貧血 | 白血球減少、好酸球増多、白血球増多、血小板減少 |
|---|
腎臓 | BUN、クレアチニンの上昇 | 蛋白尿 |
|---|
その他 | 血中カリウム上昇、血中尿酸上昇、血中CK上昇 | 倦怠感、脱力感、咳、浮腫、視覚異常、総コレステロール上昇、低ナトリウム血症、血清総タンパク減少 |
|---|
適用上の注意
薬剤交付時の注意
〈製剤共通〉
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
〈OD錠〉
本剤は舌の上にのせ唾液を湿潤させ、唾液のみで服用可能である。また、水で服用することもできる。
本剤は寝たままの状態では、水なしで服用させないこと。
薬物動態
血中濃度
血中カンデサルタン濃度測定値を用いたPopulation Pharmacokinetics(PPK)解析
健康成人男子延べ168例、本態性高血圧症及び高齢本態性高血圧症患者延べ30例、腎障害を伴う高血圧症患者18例、肝障害を伴う高血圧症患者8例、計224例から得られた2,886時点の血中カンデサルタン濃度測定値を用いて、性、年齢、体重、肝機能指標(AST、ALT)、腎機能指標(血清クレアチニン、BUN)、血中アルブミン値及び高血圧の有無とカンデサルタンのクリアランス、分布容積、相対的バイオアベイラビリティとの関連性を検討した結果、肝障害患者(AST値>40又はALT値>35)におけるクリアランスが45%低下することが推定されている。
生物学的同等性試験
〈カンデサルタン錠4mg「トーワ」〉
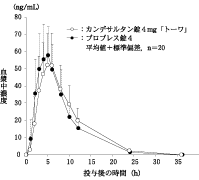
カンデサルタン錠4mg「トーワ」とブロプレス錠4を、クロスオーバー法によりそれぞれ1錠(カンデサルタン シレキセチルとして4mg)健康成人男子に絶食単回経口投与して活性代謝物であるカンデサルタンの血漿中濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)~log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
| 判定パラメータ | 参考パラメータ |
AUC0~36h (ng・h/mL) | Cmax (ng/mL) | Tmax (h) | T1/2 (h) |
カンデサルタン錠4mg「トーワ」 | 533.8±185.7 | 56.81±20.50 | 5.15±0.88 | 3.93±0.61 |
ブロプレス錠4 | 516.9±179.2 | 60.39±17.92 | 4.55±0.89 | 3.60±0.53 |
〈カンデサルタン錠8mg「トーワ」〉
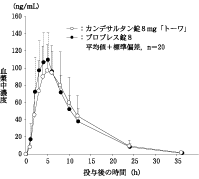
カンデサルタン錠8mg「トーワ」とブロプレス錠8を、クロスオーバー法によりそれぞれ1錠(カンデサルタン シレキセチルとして8mg)健康成人男子に絶食単回経口投与して活性代謝物であるカンデサルタンの血漿中濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)~log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
| 判定パラメータ | 参考パラメータ |
AUC0~36h (ng・h/mL) | Cmax (ng/mL) | Tmax (h) | T1/2 (h) |
カンデサルタン錠8mg「トーワ」 | 1161±495 | 107.8±33.2 | 5.20±1.28 | 5.15±1.78 |
ブロプレス錠8 | 1155±346 | 116.0±31.3 | 4.40±0.94 | 4.86±0.99 |
〈カンデサルタン錠12mg「トーワ」〉
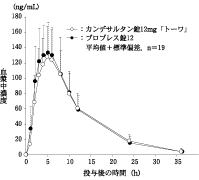
カンデサルタン錠12mg「トーワ」とブロプレス錠12を、クロスオーバー法によりそれぞれ1錠(カンデサルタン シレキセチルとして12mg)健康成人男子に絶食単回経口投与して活性代謝物であるカンデサルタンの血漿中濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)~log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
| 判定パラメータ | 参考パラメータ |
AUC0~36h (ng・h/mL) | Cmax (ng/mL) | Tmax (h) | T1/2 (h) |
カンデサルタン錠12mg「トーワ」 | 1641±434 | 141.8±48.4 | 5.26±1.37 | 6.40±2.35 |
ブロプレス錠12 | 1693±426 | 150.3±38.9 | 4.79±1.23 | 5.92±1.43 |
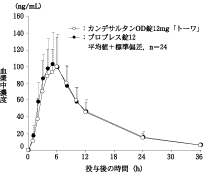
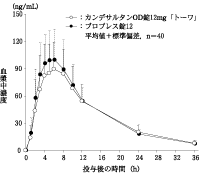
〈カンデサルタンOD錠12mg「トーワ」〉
カンデサルタンOD錠12mg「トーワ」とブロプレス錠12を、クロスオーバー法によりそれぞれ1錠(カンデサルタンシレキセチルとして12mg)健康成人男子に絶食単回経口投与(水なしで服用及び水で服用)して活性代謝物であるカンデサルタンの血漿中濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)~log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
(1) 水なしで服用(ブロプレス錠12は水で服用)
| 判定パラメータ | 参考パラメータ |
AUC0~36h (ng・h/mL) | Cmax (ng/mL) | Tmax (h) | T1/2 (h) |
カンデサルタン
OD錠12mg「トーワ」 | 1262±265 | 109.6±32.4 | 5.3±1.5 | 8.07±3.30 |
ブロプレス錠12 | 1325±329 | 110.5±41.4 | 4.9±1.2 | 8.16±2.00 |
(2) 水で服用
| 判定パラメータ | 参考パラメータ |
AUC0~36h (ng・h/mL) | Cmax (ng/mL) | Tmax (h) | T1/2 (h) |
カンデサルタン
OD錠12mg「トーワ」 | 1405±367 | 102.6±33.1 | 5.7±1.8 | 9.01±2.68 |
ブロプレス錠12 | 1470±353 | 112.3±35.6 | 5.4±1.8 | 8.65±2.81 |
PharmacokineticsEtc
〈カンデサルタン錠2mg「トーワ」〉
カンデサルタン錠2mg「トーワ」は、カンデサルタン錠4mg「トーワ」を標準製剤としたとき、溶出挙動が同等と判断され、生物学的に同等とみなされた。
〈カンデサルタンOD錠2mg「トーワ」、カンデサルタンOD錠4mg「トーワ」、カンデサルタンOD錠8mg「トーワ」〉
カンデサルタンOD錠2mg「トーワ」、カンデサルタンOD錠4mg「トーワ」及びカンデサルタンOD錠8mg「トーワ」は、カンデサルタンOD錠12mg「トーワ」を標準製剤としたとき、溶出挙動が同等と判断され、生物学的に同等とみなされた。,,
有効成分に関する理化学的知見
一般的名称
カンデサルタン シレキセチル(Candesartan Cilexetil)
化学名
(1RS)-1-(Cyclohexyloxycarbonyloxy)ethyl 2-ethoxy-1-{[2´-(1H-tetrazol-5-yl)biphenyl-4-yl]methyl}-1H-benzimidazole-7-carboxylate
分子式
C33H34N6O6
分子量
610.66
性状
白色の結晶又は結晶性の粉末である。酢酸(100)にやや溶けやすく、メタノールにやや溶けにくく、エタノール(99.5)に溶けにくく、水にほとんど溶けない。メタノール溶液(1→100)は旋光性を示さない。結晶多形が認められる。
化学構造式
包装
〈カンデサルタン錠2mg「トーワ」〉
100錠[10錠×10:PTP]
〈カンデサルタン錠4mg「トーワ」〉
100錠[10錠×10:PTP]
500錠[10錠×50:PTP]
140錠[14錠×10:PTP]
700錠[14錠×50:PTP]
300錠[バラ]
〈カンデサルタン錠8mg「トーワ」〉
100錠[10錠×10:PTP]
500錠[10錠×50:PTP]
140錠[14錠×10:PTP]
700錠[14錠×50:PTP]
300錠[バラ]
〈カンデサルタン錠12mg「トーワ」〉
100錠[10錠×10:PTP]
500錠[10錠×50:PTP]
140錠[14錠×10:PTP]
〈カンデサルタンOD錠2mg「トーワ」〉
100錠[10錠×10:PTP、乾燥剤入り]
300錠[バラ、乾燥剤入り]
〈カンデサルタンOD錠4mg「トーワ」〉
100錠[10錠×10:PTP、乾燥剤入り]
500錠[10錠×50:PTP、乾燥剤入り]
140錠[14錠×10:PTP、乾燥剤入り]
300錠[バラ、乾燥剤入り]
〈カンデサルタンOD錠8mg「トーワ」〉
100錠[10錠×10:PTP、乾燥剤入り]
500錠[10錠×50:PTP、乾燥剤入り]
140錠[14錠×10:PTP、乾燥剤入り]
300錠[バラ、乾燥剤入り]
〈カンデサルタンOD錠12mg「トーワ」〉
100錠[10錠×10:PTP、乾燥剤入り]
140錠[14錠×10:PTP、乾燥剤入り]
300錠[バラ、乾燥剤入り]
主要文献
1
阿部真也 他:周産期医学.2017;47:1353-1355
2
齊藤大祐 他:鹿児島産科婦人科学会雑誌.2021;29:49-54
3
大島洋次郎 他:薬理と治療.1996;24:S875-S888
4
第十八改正日本薬局方解説書.2021;C-1455-1461
5
社内資料:生物学的同等性試験(錠4mg)
6
社内資料:生物学的同等性試験(錠8mg)
7
社内資料:生物学的同等性試験(錠12mg)
8
社内資料:生物学的同等性試験(OD錠12mg)
9
社内資料:生物学的同等性試験(錠2mg)
10
社内資料:生物学的同等性試験(OD錠2mg)
11
社内資料:生物学的同等性試験(OD錠4mg)
12
社内資料:生物学的同等性試験(OD錠8mg)
文献請求先及び問い合わせ先
〒570-0081 大阪府守口市日吉町2丁目5番15号
製造販売業者等























 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379

