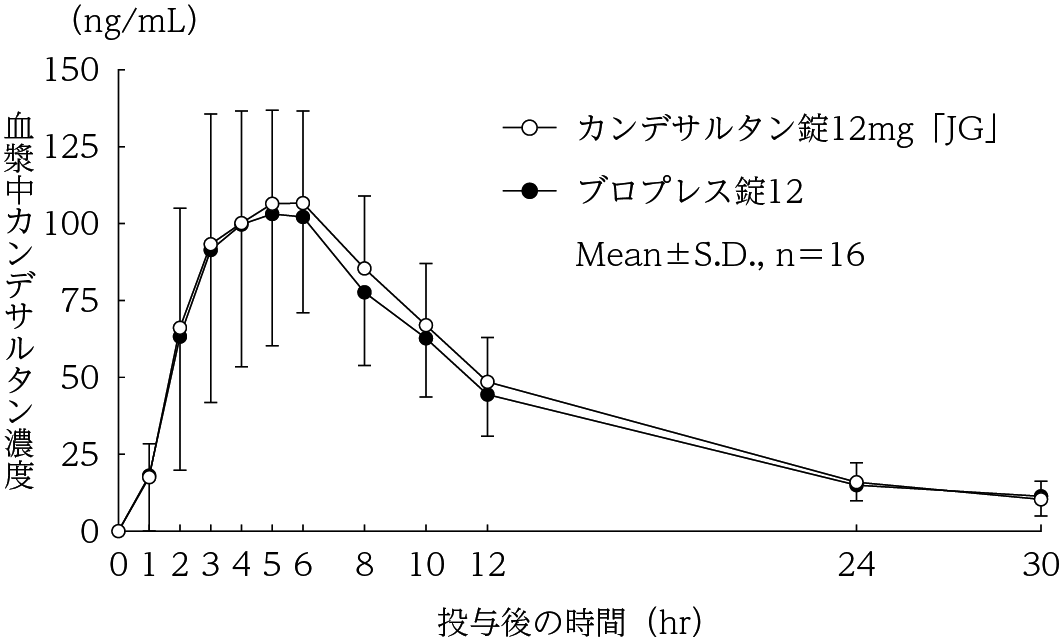
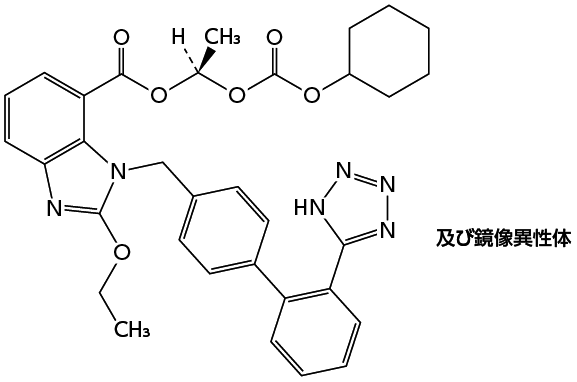
1
阿部真也 他:周産期医学 2017;47:1353-1355
2
齊藤大祐 他:鹿児島産科婦人科学会雑誌 2021;29:49-54
3
大島洋次郎 他:薬理と治療 1996;24:S875-S888
4
鈴木伸 他:臨床医薬 1996;12:2413-2428
5
第十八改正 日本薬局方解説書 廣川書店 2021;C1455-C1461
6
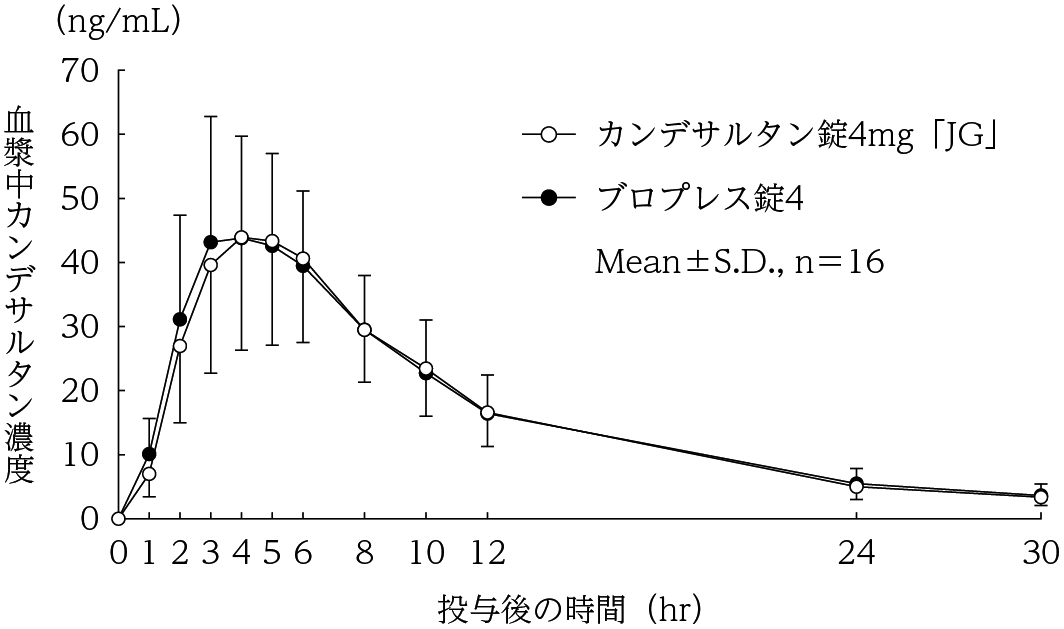
社内資料:生物学的同等性試験(錠4mg)
7
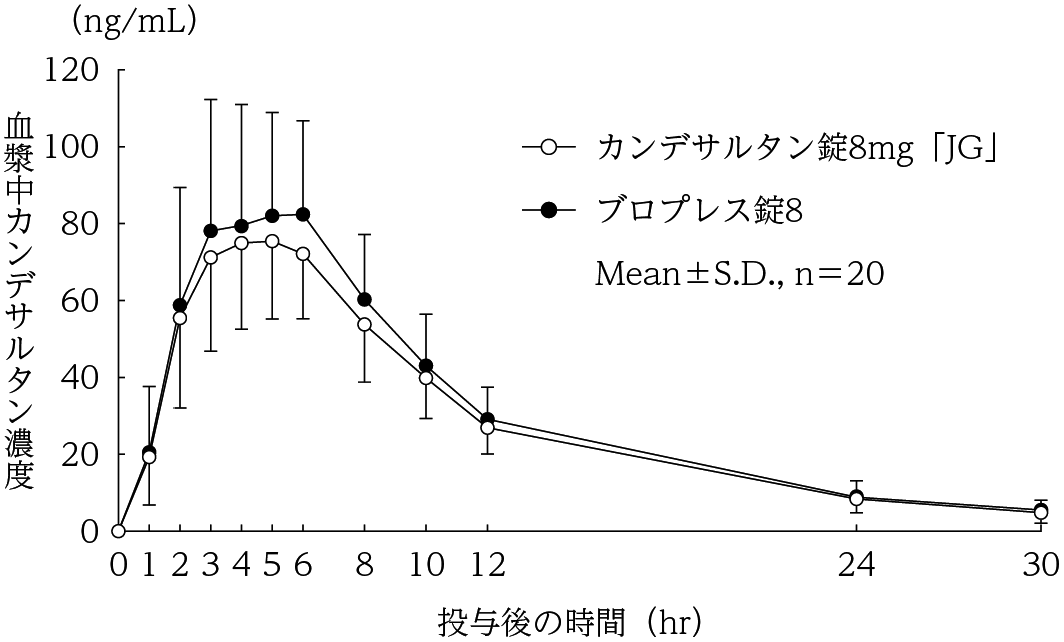
社内資料:生物学的同等性試験(錠8mg)
8
社内資料:生物学的同等性試験(錠12mg)
9
近藤孝浩 他:薬理と治療 1996;24(Suppl 6):S915-S943
10
代謝(ユニシア配合錠:2010年4月16日承認、申請資料概要 2.7.2.3)
11
青井渉:臨床医薬 1996;12:2429-2441
12
藤島正敏 他:臨床医薬 1996;12:3333-3352
13
梶原英二 他:臨床医薬 1996;12:3353-3368
14
安保泰宏 他:新薬と臨牀 1996;45:1662-1668
15
メチルジゴキシンとの薬物相互作用(ブロプレス錠:2005年10月11日承認、申請資料概要 ヘ.1.(1)1))
16
社内資料:生物学的同等性試験(錠2mg)
17
藤原久義 他:臨床医薬 1996;12:3281-3297
18
荒川規矩男 他:臨床医薬 1996;12:2195-2211
19
荒川正昭 他:臨床医薬 1996;12:2267-2296
20
荒川規矩男 他:臨床医薬 1996;12:2213-2230
21
荒川規矩男 他:臨床医薬 1998;14:2765-2800
22
猿田享男 他:臨床医薬 1996;12:2297-2322
23
飯村攻 他:臨床医薬 1996;12:2323-2341
24
藤島正敏 他:臨床医薬 1996;12:2343-2371
25
阿部圭志 他:臨床医薬 1996;12:2373-2392
26
阿部圭志 他:臨床医薬 1996;12:2393-2411
27
荒川規矩男 他:臨床医薬 1998;14:871-918
28
梶山梧朗 他:臨床医薬 1996;12:3299-3317
29
荻原俊男 他:臨床医薬 1996;12:3211-3228
30
柊山幸志郎 他:臨床医薬 1996;12:3229-3264
31
第Ⅲ相二重盲検比較試験(慢性心不全患者)(ブロプレス錠:2005年10月11日承認、申請資料概要 ト.1.(3))
32
心血管系イベント(慢性心不全患者)(ブロプレス錠:2005年10月11日承認、申請資料概要 ト.2.(2)5))
33
野田昌邦 他:薬理と治療 1996;24:2215-2220
34
柴生田由美子 他:薬理と治療 1996;24:2207-2213
35
Wada, T. et al.:Eur. J. Pharmacol. 1994;253:27-34
36
第十八改正 日本薬局方解説書 廣川書店 2021;C1466-C1474
37
三ツ浪健一 他:新薬と臨牀 1996;45:1655-1661
38
伊勢拓之 他:臨床医薬 1996;12:3265-3280
39
田川皓一 他:臨床医薬 1996;12:3319-3331
40
心血行動態及び心室リモデリングに対する改善効果(慢性心不全患者)(ブロプレス錠:2005年10月11日承認、申請資料概要 ト.2.(1)3))