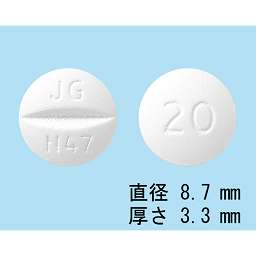
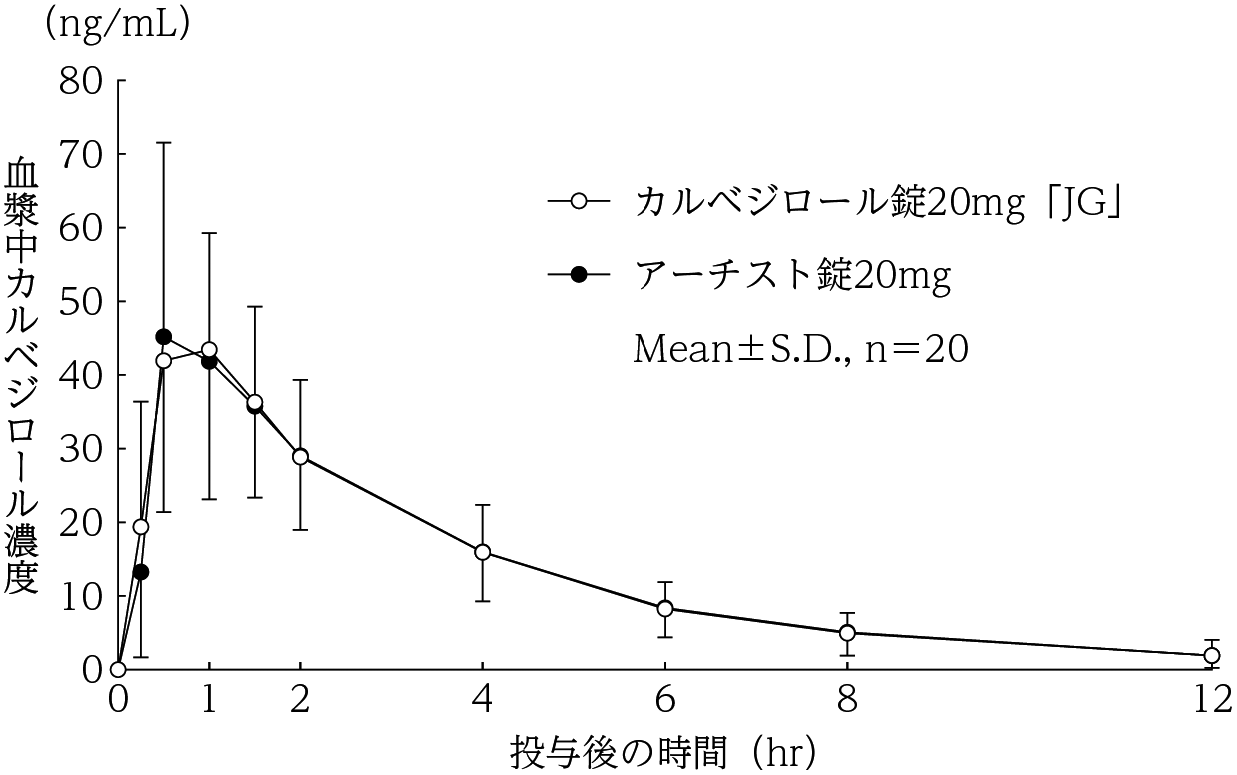
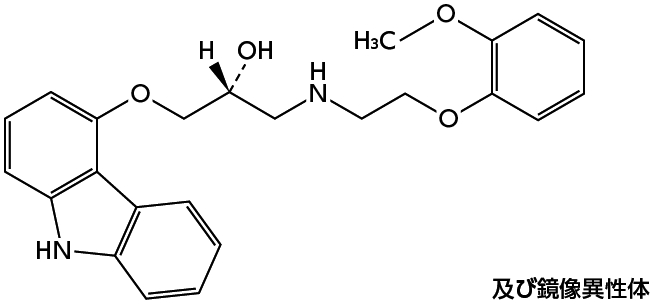
1
藤巻正慶 他:臨床薬理 1990;21(2):415-424
2
荻原俊男 他:臨床と研究 1989;66(5):1660-1666
3
第十八改正 日本薬局方解説書 廣川書店 2021;C1406-C1414
4
都築雅人 他:臨床薬理 1990;21(3):521-534
5
慢性心不全患者における薬物動態(アーチスト錠:2002年10月8日承認、申請資料概要 ヘ.2.2.1)
6
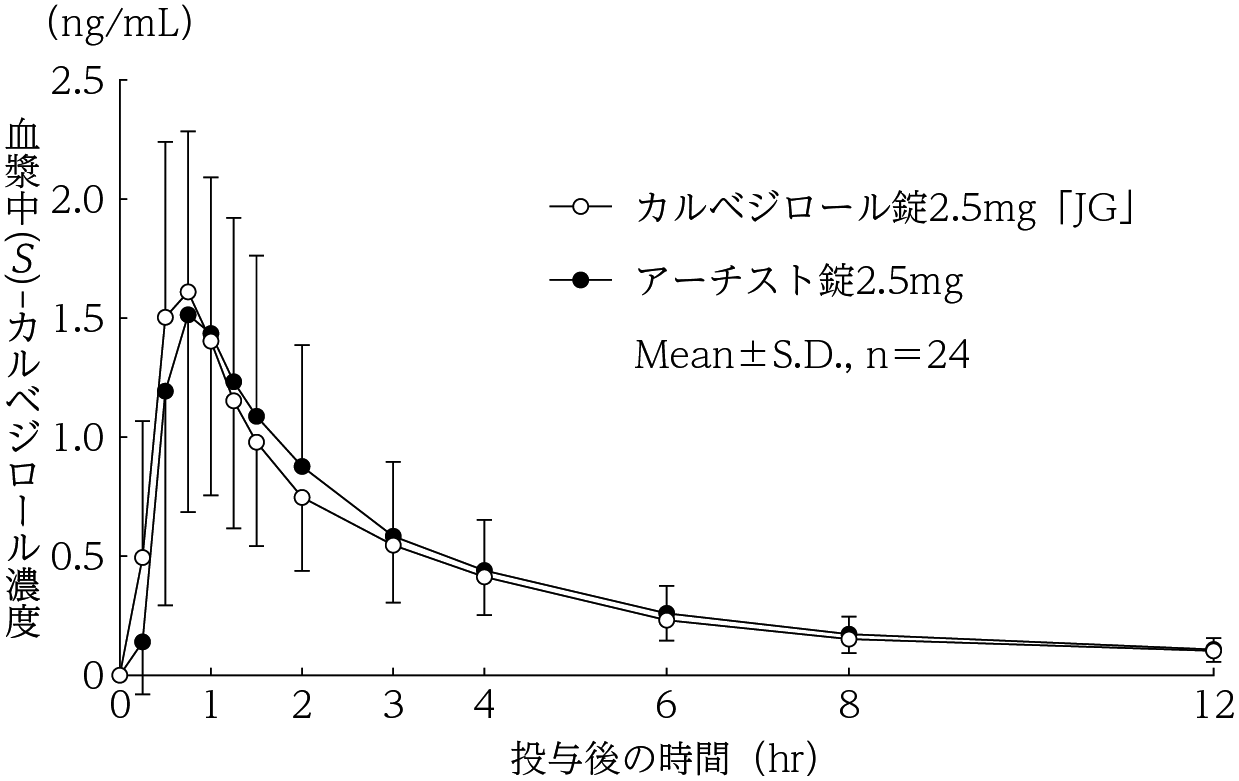
社内資料:生物学的同等性試験(錠2.5mg)
7
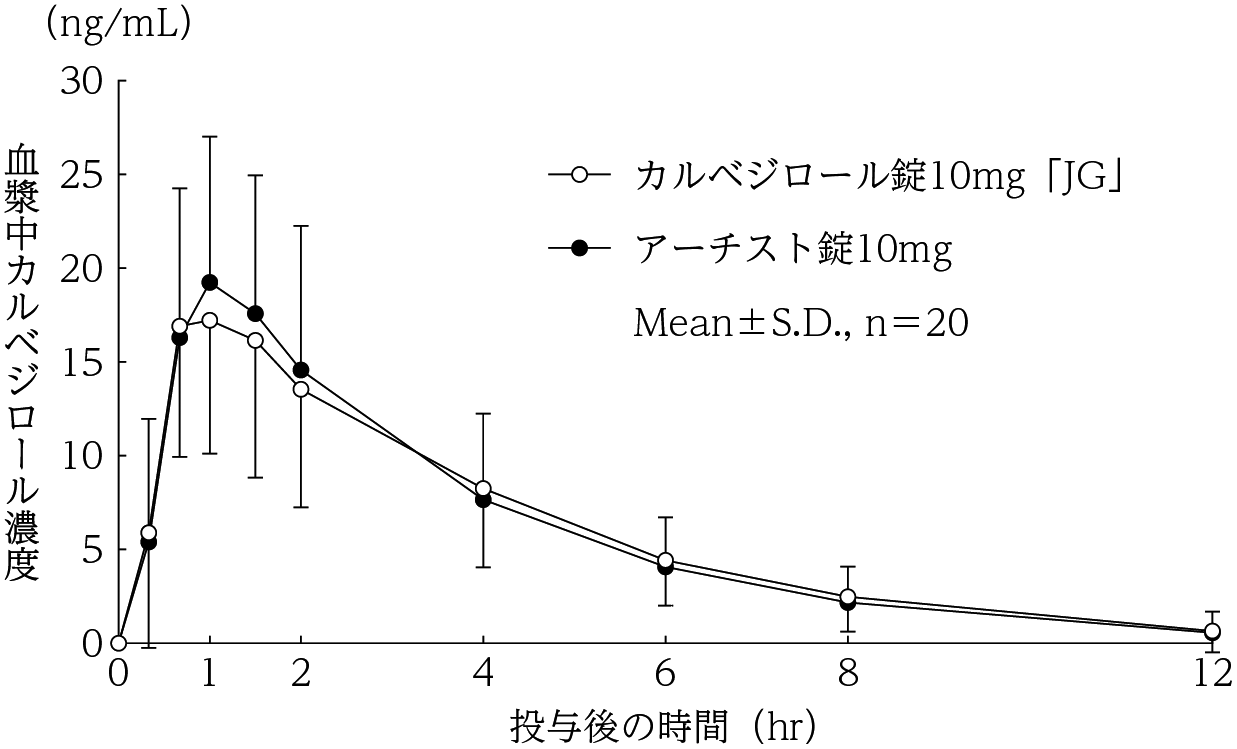
社内資料:生物学的同等性試験(錠10mg)
8
社内資料:生物学的同等性試験(錠20mg)
9
Möllendorff, E.V. et al.:Eur. J. Clin. Pharmacol. 1987;33(5):511-513
10
参考(アーチスト錠:2002年10月8日承認、申請資料概要 ヘ.6)
11
Oldham, H.G. et al.:Drug Metab. Dispos. 1997;25(8):970-977
12
Hakusui, H. et al.:Drugs. 1988;36(Suppl. 6):144-147
13
三木茂裕 他:日本透析医学会雑誌 1991;24(4):515-521
14
Neugebauer, G. et al.:Drugs. 1988;36(Suppl. 6):148-154
15
社内資料:生物学的同等性試験(錠1.25mg)
16
五島雄一郎 他:臨床と研究 1990;67(6):1869-1894
17
五島雄一郎 他:臨床と研究 1990;67(3):965-984
18
武田忠直 他:診断と治療 1994;82(3):506-522
19
加藤和三 他:臨床と研究 1990;67(3):985-995
20
加藤和三 他:臨床と研究 1990;67(2):618-631
21
加藤和三 他:臨床と研究 1990;67(2):632-648
22
血行動態に及ぼす影響(アーチスト錠:2002年10月8日承認、申請資料概要 ト.1.3.1)
23
慢性心不全患者を対象とした薬物動態試験(アーチスト錠:2002年10月8日承認、申請資料概要 ト.1.3.2)
24
神経体液性因子に及ぼす影響(アーチスト錠:2002年10月8日承認、申請資料概要 ト.1.3.3)
25
Hori, M. et al.:Am. Heart J. 2004;147(2):324-330
26
後期第Ⅱ相試験(軽症~中等症慢性心不全)(アーチスト錠:2002年10月8日承認、申請資料概要 ト.1.2)
27
Packer, M. et al.:N. Engl. J. Med. 1996;334(21):1349-1355
28
第Ⅲ相試験(主に軽症~中等症慢性心不全)(アーチスト錠:2002年10月8日承認、申請資料概要 ト.2.3)
29
Packer, M. et al.:N. Engl. J. Med. 2001;344(22):1651-1658
30
第Ⅲ相試験(重症慢性心不全)(アーチスト錠:2002年10月8日承認、申請資料概要 ト.2.4.1、ト.3.2.2)
31
Inoue, H. et al.:J. Cardiol. 2017;69(1):293-301
32
国内第Ⅲ相試験(アーチスト錠:2015年8月24日承認、審査報告書)
33
効力を裏付ける試験(アーチスト錠:2002年10月8日承認、申請資料概要 ホ.4.Ⅰ)
34
Sponer, G. et al.:J. Cardiovasc. Pharmacol. 1987;9(3):317-327
35
Nakamoto, H. et al.:Drugs. 1988;36(Suppl. 6):160-164
36
吉永馨 他:臨床と研究 1989;66(11):3684-3692
37
Seki, N. et al.:J. Pharmacol. Exp. Ther. 1988;246(3):1116-1122
38
Tomlinson, B. et al.:Drugs. 1988;36(Suppl. 6):37-47
39
Lahiri, A. et al.:Am. J. Cardiol. 1987;59(8):769-774
40
Kohno, M. et al.:Drugs. 1988;36(Suppl. 6):165-168
41
Tamaki, T. et al.:Drugs. 1988;36(Suppl. 6):155-159
42
Kawada, T. et al.:J. Cardiovasc. Pharmacol. 1990;16(1):147-153
43
岸田浩 他:診断と治療 1989;77(11):3024-3032
44
河田登美枝 他:心筋の構造と代謝-1989-心筋代謝研究会編 1990;12:401-414
45
Feuerstein, G.Z. et al.:J. Cardiovasc. Pharmacol. 1992;19(S-1):S138-S141
46
ラット冠動脈結紮モデル(アーチスト錠:2002年10月8日承認、申請資料概要 ホ.1.3)
47
Dahl食塩感受性ラット(アーチスト錠:2002年10月8日承認、申請資料概要 ホ.1.1)
48
Mishima, T. et al.:Circulation. 2000;102(18):534
49
Yue, T.L. et al.:J. Pharmacol. Exp. Ther. 1992;263(1):92-98