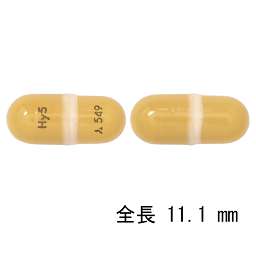
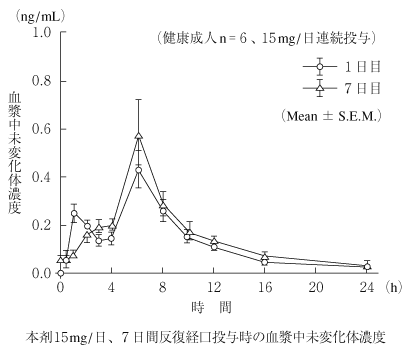
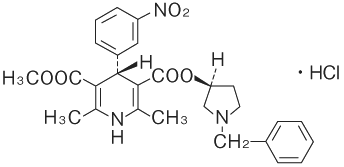
1
橋本敬太郎 他: 基礎と臨床 1990 ; 24(9): 4443-4458[HY-00013]
2
Teramura, T. et al.: Xenobiotica.1995 ; 25(11): 1237-1246[HY-00240]
3
Teramura, T. et al.: Xenobiotica.1997 ; 27(9): 885-900[HY-00270]
4
吉永 馨 他: 診療と新薬 1990 ; 27(9): 1657-1670[HY-00029]
5
吉永 馨 他: 腎と透析 1990 ; 29(6): 1045-1058[HY-00047]
6
吉永 馨 他: 腎と透析 1991 ; 30(1): 121-126[HY-00034]
7
吉永 馨 他: Ther. Res.1994 ; 15(8): 3267-3275[HY-0082]
8
吉永 馨 他: 医学のあゆみ 1991 ; 156(8): 543-560[HY-00026]
9
稲垣 治 他: 基礎と臨床 1990 ; 24(10): 5271-5284[HY-00018]
10
吉永 馨 他: 医学と薬学 1990 ; 23(6): 1377-1387[HY-00011]
11
吉永 馨 他: 基礎と臨床 1990 ; 24(9): 4495-4507[HY-00010]
12
稲垣 治 他: 基礎と臨床 1992 ; 26(7): 3171-3178[HY-014]
13
野田汎史 他: 基礎と臨床 1990 ; 24(8): 4047-4053[HY-0004]
14
稲垣 治 他: 基礎と臨床 1992 ; 26(7): 3163-3169[HY-016]
15
稲垣 治 他: 基礎と臨床 1990 ; 24(10): 5285-5294[HY-00022]
16
Kawashima, K. et al.: Gen. Pharmacol.1991 ; 22(2): 263-266[HY-00023]