作成又は改訂年月
**
2019年12月改訂
(第11版、販売名変更に伴う改訂)
**
2017年4月改訂
日本標準商品分類番号
薬効分類名
承認等
販売名
**ドキサゾシン錠0.5mg「MEEK」
販売名コード
承認・許可番号
**30100AMX00087000
DOXAZOSIN Tablets 0.5mg「MEEK」
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
室温保存注1)
注1)「取扱い上の注意」の項参照
使用期限:
外箱に表示
基準名
規制区分
処方箋医薬品注2)
注2)注意−医師等の処方箋により使用すること
組成
成分・含量
1錠中、日局ドキサゾシンメシル酸塩0.6064mg(ドキサゾシンとして0.5mg)含有
添加物
乳糖水和物、結晶セルロース、ヒドロキシプロピルスターチ、部分アルファー化デンプン、ポビドン、サッカリンナトリウム水和物、ステアリン酸マグネシウム、香料
性状
白色の素錠
大きさ
直径:約5.6mm
厚さ:約2.8mm
重量:約60mg
外形
識別コード
MK31
販売名
**ドキサゾシン錠1mg「MEEK」
販売名コード
承認・許可番号
**30100AMX00088000
DOXAZOSIN Tablets 1mg「MEEK」
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
室温保存注1)
注1)「取扱い上の注意」の項参照
使用期限:
外箱に表示
基準名
規制区分
処方箋医薬品注2)
注2)注意−医師等の処方箋により使用すること
組成
成分・含量
1錠中、日局ドキサゾシンメシル酸塩1.2129mg(ドキサゾシンとして1mg)含有
添加物
乳糖水和物、結晶セルロース、ヒドロキシプロピルスターチ、部分アルファー化デンプン、ラウリル硫酸ナトリウム、ポビドン、サッカリンナトリウム水和物、ステアリン酸マグネシウム、香料
性状
白色の割線入りの素錠
大きさ
直径:約7.1mm
厚さ:約2.5mm
重量:約120mg
外形
識別コード
MK09
販売名
**ドキサゾシン錠2mg「MEEK」
販売名コード
承認・許可番号
**30100AMX00089000
DOXAZOSIN Tablets 2mg「MEEK」
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
室温保存注1)
注1)「取扱い上の注意」の項参照
使用期限:
外箱に表示
基準名
規制区分
処方箋医薬品注2)
注2)注意−医師等の処方箋により使用すること
組成
成分・含量
1錠中、日局ドキサゾシンメシル酸塩2.4257mg(ドキサゾシンとして2mg)含有
添加物
乳糖水和物、結晶セルロース、ヒドロキシプロピルスターチ、部分アルファー化デンプン、ラウリル硫酸ナトリウム、サッカリンナトリウム水和物、ステアリン酸マグネシウム、黄色5号、香料
性状
淡いだいだい色の割線入りの素錠
大きさ
直径:約7.1mm
厚さ:約2.5mm
重量:約120mg
外形
識別コード
MK10
販売名
**ドキサゾシン錠4mg「MEEK」
販売名コード
承認・許可番号
**30100AMX00097000
DOXAZOSIN Tablets 4mg「MEEK」
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法:
室温保存注1)
注1)「取扱い上の注意」の項参照
使用期限:
外箱に表示
基準名
規制区分
処方箋医薬品注2)
注2)注意−医師等の処方箋により使用すること
組成
成分・含量
1錠中、日局ドキサゾシンメシル酸塩4.8514mg(ドキサゾシンとして4mg)含有
添加物
乳糖水和物、結晶セルロース、ヒドロキシプロピルスターチ、部分アルファー化デンプン、サッカリンナトリウム水和物、ステアリン酸マグネシウム、香料
性状
白色の割線入りの素錠
大きさ
直径:約8.1mm
厚さ:約3.8mm
重量:約240mg
外形
識別コード
MK32
禁忌
効能又は効果
用法及び用量
通常、成人にはドキサゾシンとして1日1回0.5mgより投与を始め、効果が不十分な場合は1〜2週間の間隔をおいて1〜4mgに漸増し、1日1回経口投与する。
なお、年齢、症状により適宜増減するが、1日最高投与量は8mgまでとする。
ただし、褐色細胞腫による高血圧症に対しては1日最高投与量を16mgまでとする。
使用上の注意
慎重投与
ホスホジエステラーゼ5阻害作用を有する薬剤を服用している患者[「相互作用」の項参照]
肝機能障害のある患者[主として肝臓で代謝されるため、血中濃度−時間曲線下面積 (AUC) が増大することがある。]
重要な基本的注意
起立性低血圧があらわれることがあるので、臥位のみならず立位又は坐位で血圧測定を行い、体位変換による血圧変化を考慮し、坐位にて血圧をコントロールすること。
本剤の投与初期又は用量の急増時等に、立ちくらみ、めまい、脱力感、発汗、動悸・心悸亢進等があらわれることがある。その際には仰臥位をとらせるなどの適切な処置を行うこと。また、必要に応じて対症療法を行うこと。
本剤の投与初期又は用量の急増時等に起立性低血圧に基づくめまい等があらわれることがあるので、高所作業、自動車の運転等危険を伴う作業に従事する場合には注意させること。
相互作用
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
| 利尿剤又は他の降圧剤 | 相互に作用を増強するおそれがあるので、減量するなど注意すること。 | 相互に作用を増強するおそれがある。 |
|---|
ホスホジエステラーゼ5阻害作用を有する薬剤
バルデナフィル塩酸塩水和物、タダラフィル、シルデナフィルクエン酸塩 | 併用によりめまい等の自覚症状を伴う症候性低血圧を来したとの報告がある。 | 血管拡張作用による降圧作用を有するため、本剤の降圧作用を増強することがある。 |
|---|
副作用
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
失神・意識喪失
(頻度不明)
失神・意識喪失があらわれることがある。これは起立性低血圧によることが多いので、このような症状があらわれた場合には投与を中止し、仰臥位をとらせるなど適切な処置を行うこと。
不整脈
(頻度不明)
不整脈があらわれることがあるので、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
脳血管障害
(頻度不明)
脳血管障害があらわれることがあるので、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
狭心症
(頻度不明)
狭心症があらわれることがあるので、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
心筋梗塞
(頻度不明)
心筋梗塞があらわれることがあるので、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
無顆粒球症、白血球減少、血小板減少
(頻度不明)
無顆粒球症、白血球減少、血小板減少があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
肝炎、肝機能障害、黄疸
(頻度不明)
肝炎、AST(GOT)、ALT(GPT)、γ-GTPの著しい上昇等を伴う肝機能障害、黄疸があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
その他の副作用
肝臓
(頻度不明)
AST(GOT)上昇、ALT(GPT)上昇、Al-P上昇、LDH上昇、胆汁うっ滞
循環器
(頻度不明)
起立性めまい、起立性低血圧、低血圧、動悸・心悸亢進、頻脈、ほてり(顔面潮紅等)、胸痛・胸部圧迫感、徐脈
精神神経系
(頻度不明)
めまい、頭痛・頭重、眩暈、眠気、不眠、しびれ感、耳鳴、興奮、振戦、知覚鈍麻、不安、うつ病、神経過敏
消化器
(頻度不明)
悪心・嘔吐、腹痛、口渇、食欲不振、下痢、便秘、消化不良、鼓腸放屁
筋骨格系
(頻度不明)
関節痛、筋力低下、筋痙直、筋肉痛、背部痛
呼吸器
(頻度不明)
息苦しさ、鼻出血、鼻炎、咳、気管支痙攣悪化、呼吸困難
泌尿生殖器
(頻度不明)
頻尿・夜間頻尿、尿失禁、持続勃起、勃起障害、射精障害(逆行性射精等)、血尿、排尿障害、多尿
過敏症注)
(頻度不明)
発疹、そう痒感、蕁麻疹、血管浮腫、光線過敏症
血液
(頻度不明)
白血球減少、血小板減少、紫斑
眼
(頻度不明)
かすみ目、術中虹彩緊張低下症候群(IFIS)
その他
(頻度不明)
けん怠感、浮腫、脱力感、異常感覚、発熱、発汗、疼痛、体重増加、女性化乳房、脱毛
以上のような副作用が認められた場合には、必要に応じ、減量、投与中止等の適切な処置を行うこと。
注) 発現した場合には投与を中止すること。
高齢者への投与
高齢者では一般に過度の降圧は好ましくないとされている(脳梗塞等が起こるおそれがある)ので、低用量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。
妊婦、産婦、授乳婦等への投与
妊娠中の投与に関する安全性は確立していないので、妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上まわると判断される場合にのみ投与すること。
*ヒト母乳中への移行が報告されている1)ので、授乳中の婦人に投与する場合には授乳を中止させることが望ましい。
胎仔器官形成期投与試験にて、ラットへの120mg/kg投与及びウサギへの100mg/kg投与により胎仔死亡率の増加が報告されている。
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない。
過量投与
症状:
過量投与により低血圧を起こす可能性がある。
処置:
過量投与の結果低血圧になった場合には、直ちに患者を足高仰臥位に保つ。その他必要に応じて適切な処置を行う。本剤は蛋白結合率が高いため、透析は有用ではない。
適用上の注意
薬剤交付時:
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。[PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。]
その他の注意
α1遮断薬を服用中又は過去に服用経験のある患者において、α1遮断作用によると考えられる術中虹彩緊張低下症候群(Intraoperative Floppy Iris Syndrome)があらわれるとの報告がある。
薬物動態
<生物学的同等性試験>
ドキサゾシン錠1mg「MEEK」と標準製剤又はドキサゾシン錠2mg「MEEK」と標準製剤を、クロスオーバー法によりそれぞれ1錠(ドキサゾシンとして1mg又は2mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.8)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された(図1、図2、表)。2)
また、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、ドキサゾシン錠0.5mg「MEEK」はドキサゾシン錠1mg「MEEK」を、ドキサゾシン錠4mg「MEEK」はドキサゾシン錠2mg「MEEK」をそれぞれ標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた。3)

図1 1mg錠投与時のドキサゾシンの血漿中濃度推移

図2 2mg錠投与時のドキサゾシンの血漿中濃度推移
表 薬物動態パラメータ

血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<溶出挙動>
ドキサゾシン錠0.5mg「MEEK」、ドキサゾシン錠1mg「MEEK」、ドキサゾシン錠2mg「MEEK」及びドキサゾシン錠4mg「MEEK」は、日本薬局方医薬品各条に定められたドキサゾシンメシル酸塩錠の溶出規格に適合していることが確認されている。4)
薬効薬理
アドレナリンα1受容体の選択的遮断薬。α1受容体刺激作用に拮抗し、血管平滑筋のα1受容体を遮断して降圧作用を示す。5)
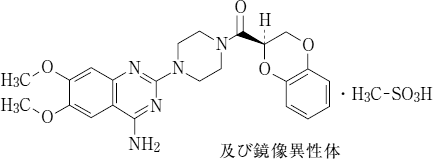
有効成分に関する理化学的知見
一般名:
ドキサゾシンメシル酸塩(Doxazosin Mesilate)
化学名:
1-(4-Amino-6,7-dimethoxyquinazolin-2-yl)-4-{[(2RS )-2,3-dihydro-1,4-benzodioxin-2-yl]carbonyl}piperazine monomethanesulfonate
分子式:
C23H25N5O5・CH4O3S
分子量:
547.58
性状:
白色〜帯黄白色の結晶性の粉末である。
ジメチルスルホキシドに溶けやすく、水又はメタノールに溶けにくく、エタノール(99.5)に極めて溶けにくい。
ジメチルスルホキシド溶液(1→20)は旋光性を示さない。
融点:約272℃(分解)
構造式:
取扱い上の注意
開封後は湿気を避けて保存すること。
<安定性試験>
最終包装製品を用いた加速試験(40℃、75%RH、6ヵ月)の結果、ドキサゾシン錠0.5mg「MEEK」、ドキサゾシン錠1mg「MEEK」、ドキサゾシン錠2mg「MEEK」及びドキサゾシン錠4mg「MEEK」は通常の市場流通下において3年間安定であることが推測された。6)
包装
ドキサゾシン錠0.5mg「MEEK」
PTP:100錠
ドキサゾシン錠1mg「MEEK」
PTP:100錠 500錠
ドキサゾシン錠2mg「MEEK」
PTP:100錠 500錠
ドキサゾシン錠4mg「MEEK」
PTP:100錠
主要文献及び文献請求先
主要文献
1
*Berit, P. J. et al.:J Hum Lact、29(2)、150(2013)
2
小林化工株式会社・社内資料(生物学的同等性試験)
3
小林化工株式会社・社内資料(生物学的同等性試験)
4
小林化工株式会社・社内資料(日本薬局方規格溶出試験)
5
*第十七改正日本薬局方解説書
6
小林化工株式会社・社内資料(安定性試験)
文献請求先
主要文献欄に記載の文献・社内資料は下記にご請求下さい。
小林化工株式会社 安全管理部
〒919-0603 福井県あわら市矢地5-15
フリーダイヤル 0120-37-0690 TEL 0776-73-0911
FAX 0776-73-0821
製造販売業者等の氏名又は名称及び住所
製造販売元
小林化工株式会社
福井県あわら市矢地5-15