1
阿部真也他:周産期医学, 2017;47:1353-1355
2
齊藤大祐他:鹿児島産科婦人科学会雑誌, 2021;29:49-54
3
安原一他:臨床医薬, 1994;10:3-26
4
安原一他:臨床医薬, 1994;10:27-43
5
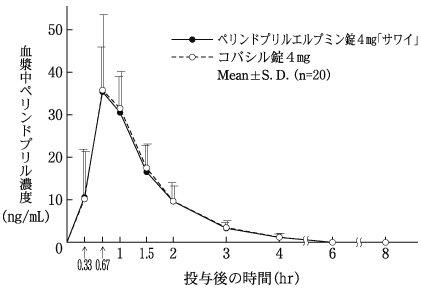
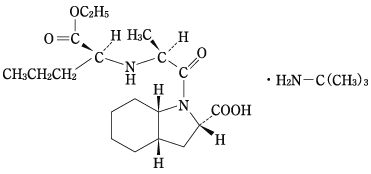
社内資料:生物学的同等性試験(錠2mg)
6
社内資料:生物学的同等性試験(錠4mg)
7
鈴木亘他:薬物動態, 1994;235-246
8
Grislain, L. et al.:Xenobiotica, 1990;20:787-800
9
Verpooten, G. A. et al.:Br. J. Clin. Pharmacol., 1991;32:187-192
10
Brown, C. L. et al.:Eur. J. Clin. Pharmacol., 1990;39:327-332
11
吉永馨他:臨床医薬, 1994;10:75-97
12
吉永馨他:臨床医薬, 1997;13:4259-4297
13
吉永馨他:臨床医薬, 1994;10:141-166
14
吉永馨他:臨床医薬, 1994;10:99-118
15
吉永馨他:臨床医薬, 1994;10:119-139
16
吉永馨他:臨床医薬, 1994;10:187-203
17
吉永馨他:臨床医薬, 1994;10:167-186
18
髙折修二他監訳:グッドマン・ギルマン薬理書, 第12版, 廣川書店, 2013;927-934
19
Jackson, B. et al.:J. Cardiovasc. Pharmacol., 1987;9:699-704
20
Laubie, M. et al.:J. Cardiovasc. Pharmacol., 1984;6:1076-1082
21
DiNicolantonio, R. et al.:J. Cardiovasc. Pharmacol., 1985;7:937-942
22
橋本博雄他:薬理と治療, 1994;22:4613-4618
23
Richer, C. et al.:J. Cardiovasc. Pharmacol., 1986;8:346-357
24
Muller, F. et al.:J. Hypertens., 1990;8:1037-1042
25
吉永馨他:臨床医薬, 1994;10:45-58
26
Morgan, T. et al.:Clin. Exp. Pharmacol. Physiol., 1992;19:61-65
27
堀越一昭他:慈恵医大誌, 2000;115:549-561
28
Levy, B. I. et al.:Circ. Res., 1988;63:227-239
29
松下哲他:薬理と治療, 1994;22:1503-1513
30
Asmar, R. G. et al.:J. Hypertens., 1988;6:S33-S39
31
Thybo, N. K. et al.:Hypertens., 1995;25:474-481