作成又は改訂年月
**
2023年5月改訂
(第7版)
*
2020年11月改訂
日本標準商品分類番号
薬効分類名
承認等
販売名
テモカプリル塩酸塩錠1mg「日医工」
販売名コード
承認・許可番号
22100AMX00194000
Temocapril Hydrochloride
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存
使用期限
外箱等に表示の使用期限内に使用すること
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
テモカプリル塩酸塩錠1mg「日医工」
1錠中テモカプリル塩酸塩1.0mgを含有する。
添加物として乳糖,ヒドロキシプロピルセルロース,硬化油,ショ糖脂肪酸エステルを含有する。
製剤の性状
| 表面 | 裏面 | 側面 | 重量
(mg) | 直径
(mm) | 厚さ
(mm) | 本体
コード | 包装
コード |
 |  |  | 100 | 6.5 | 2.3 |  060 060
1 |  060 060 |
販売名
テモカプリル塩酸塩錠2mg「日医工」
販売名コード
承認・許可番号
22100AMX00195000
Temocapril Hydrochloride
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存
使用期限
外箱等に表示の使用期限内に使用すること
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
テモカプリル塩酸塩錠2mg「日医工」
1錠中テモカプリル塩酸塩2.0mgを含有する。
添加物として乳糖,ヒドロキシプロピルセルロース,硬化油,ショ糖脂肪酸エステルを含有する。
製剤の性状
| 表面 | 裏面 | 側面 | 重量
(mg) | 直径
(mm) | 厚さ
(mm) | 本体
コード | 包装
コード |
 |  |  | 120 | 7.0 | 2.4 |  061 061
2 | 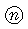 061 061 |
販売名
テモカプリル塩酸塩錠4mg「日医工」
販売名コード
承認・許可番号
22100AMX00196000
Temocapril Hydrochloride
薬価基準収載年月
販売開始年月
貯法・使用期限等
貯法
室温保存
使用期限
外箱等に表示の使用期限内に使用すること
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
テモカプリル塩酸塩錠4mg「日医工」
1錠中テモカプリル塩酸塩4.0mgを含有する。
添加物として乳糖,ヒドロキシプロピルセルロース,硬化油,ショ糖脂肪酸エステルを含有する。
製剤の性状
| 表面 | 裏面 | 側面 | 重量
(mg) | 直径
(mm) | 厚さ
(mm) | 本体
コード | 包装
コード |
 |  |  | 150 | 7.5 | 2.6 | 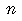 062 062
4 | 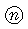 062 062 |
禁忌
本剤の成分に対し過敏症の既往歴のある患者
血管浮腫の既往歴のある患者(アンジオテンシン変換酵素阻害剤等の薬剤による血管浮腫,遺伝性血管浮腫,後天性血管浮腫,特発性血管浮腫等)[高度の呼吸困難を伴う血管浮腫を発現するおそれがある。]
デキストラン硫酸固定化セルロース,トリプトファン固定化ポリビニルアルコール又はポリエチレンテレフタレートを用いた吸着器によるアフェレーシスを施行中の患者(「相互作用」の項参照)
アクリロニトリルメタリルスルホン酸ナトリウム膜(AN69)を用いた血液透析施行中の患者(「相互作用」の項参照)
妊婦又は妊娠している可能性のある婦人(「妊婦,産婦,授乳婦等への投与」の項参照)
アリスキレンフマル酸塩を投与中の糖尿病患者(ただし,他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く)[非致死性脳卒中,腎機能障害,高カリウム血症及び低血圧のリスク増加が報告されている。](「重要な基本的注意」の項参照)
*アンジオテンシン受容体ネプリライシン阻害薬(サクビトリルバルサルタンナトリウム水和物)を投与中の患者,あるいは投与中止から36時間以内の患者(「相互作用」の項参照)
効能又は効果
用法及び用量
通常,成人にはテモカプリル塩酸塩として1日1回2〜4mg経口投与する。ただし,1日1回1mgから投与を開始し,必要に応じ4mgまで漸次増量する。
使用上の注意
慎重投与
1両側性腎動脈狭窄のある患者又は片腎で腎動脈狭窄のある患者(「重要な基本的注意」の項参照)
2高カリウム血症の患者(「重要な基本的注意」の項参照)
3重篤な腎障害のある患者[過度の血圧低下が起こるおそれがあるので,クレアチニンクリアランスが30mL/分以下,又は血清クレアチニン値が3mg/dLを超える場合には,投与量を減らすか,又は投与間隔をのばすなど慎重に投与すること。]
4重篤な肝障害のある患者[肝機能が悪化するおそれがある。]
5高齢者(「高齢者への投与」の項参照)
重要な基本的注意
1両側性腎動脈狭窄のある患者又は片腎で腎動脈狭窄のある患者においては,腎血流量の減少や糸球体ろ過圧の低下により急速に腎機能を悪化させるおそれがあるので,治療上やむを得ないと判断される場合を除き,使用は避けること。
2高カリウム血症の患者においては,高カリウム血症を増悪させるおそれがあるので,治療上やむを得ないと判断される場合を除き,使用は避けること。
また,腎機能障害,コントロール不良の糖尿病等により血清カリウム値が高くなりやすい患者では,高カリウム血症が発現するおそれがあるので,血清カリウム値に注意すること。
3本剤の投与によって次の患者では,初回投与後,一過性の急激な血圧低下を起こす場合があるので,投与は少量より開始し,増量する場合は患者の状態を十分に観察しながら徐々に行うこと。
1重症の高血圧症患者
2血液透析中の患者
3利尿降圧剤投与中の患者(特に最近利尿降圧剤投与を開始した患者)
4厳重な減塩療法中の患者
4アリスキレンフマル酸塩を併用する場合,腎機能障害,高カリウム血症及び低血圧を起こすおそれがあるため,患者の状態を観察しながら慎重に投与すること。なお,eGFRが60mL/min/1.73m2未満の腎機能障害のある患者へのアリスキレンフマル酸塩との併用については,治療上やむを得ないと判断される場合を除き避けること。
5降圧作用に基づくめまい,ふらつきがあらわれることがあるので,高所作業,自動車の運転等危険を伴う機械を操作する際には注意させること。
6手術前24時間は投与しないことが望ましい。
相互作用
併用禁忌
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
デキストラン硫酸固定化セルロース,トリプトファン固定化ポリビニルアルコール又はポリエチレンテレフタレートを用いた吸着器によるアフェレーシスの施行
リポソーバー,
イムソーバTR,
セルソーバ | ショックを起こすおそれがある。 | 陰性に荷電したデキストラン硫酸固定化セルロース,トリプトファン固定化ポリビニルアルコール又はポリエチレンテレフタレートによりブラジキニンの産生が刺激される。さらに本剤が,ブラジキニンの代謝を抑制するため,ブラジキニンの血中濃度が上昇する。 |
| アクリロニトリルメタリルスルホン酸ナトリウム膜(AN69)を用いた透析 | アナフィラキシーを発現することがある。 | 陰性に荷電したAN69膜によりブラジキニンの産生が刺激される。さらに本剤が,ブラジキニンの代謝を抑制するため,ブラジキニンの血中濃度が上昇する。 |
*アンジオテンシン受容体ネプリライシン阻害薬(ARNI)
サクビトリルバルサルタンナトリウム水和物(エンレスト) | 血管浮腫があらわれるおそれがある。本剤投与終了後にARNIを投与する場合は,本剤の最終投与から36時間後までは投与しないこと。また,ARNIが投与されている場合は,少なくとも本剤投与開始36時間前に中止すること。 | 併用により相加的にブラジキニンの分解が抑制され,ブラジキニンの血中濃度が上昇する可能性がある。 |
併用注意
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
カリウム保持性利尿剤
スピロノラクトン,
トリアムテレン等
カリウム補給剤
塩化カリウム等 | 血清カリウム値が上昇するおそれがあるので,血清カリウム値に注意すること。 | 機序:本剤はアンジオテンシンII産生を抑制し,アルドステロンの分泌を低下させるため,カリウム排泄を減少させる。
危険因子:腎障害のある患者 |
利尿降圧剤
トリクロルメチアジド,
ヒドロクロロチアジド等 | 本剤初回投与後,一過性の急激な血圧低下を起こすおそれがあるので,投与は少量より開始すること。 | 利尿降圧剤によるナトリウム排泄によって,レニン−アンジオテンシン系が亢進されているため,本剤によりアンジオテンシンIIの産生が抑制されると,降圧作用が増強されると考えられている。 |
リチウム製剤
炭酸リチウム | 他のアンジオテンシン変換酵素阻害剤(カプトプリル,エナラプリルマレイン酸塩,リシノプリル水和物)との併用により,リチウム中毒を起こすことが報告されているので,血中のリチウム濃度に注意すること。 | 明確な機序は不明であるが,ナトリウムイオン不足はリチウムイオンの貯留を促進するといわれているため,本剤がナトリウム排泄を促進することにより起こると考えられる。 |
| ニトログリセリン | 降圧作用が増強されるおそれがある。 | 両剤の降圧作用による。 |
| アリスキレンフマル酸塩 | 腎機能障害,高カリウム血症及び低血圧を起こすおそれがあるため,腎機能,血清カリウム値及び血圧を十分に観察すること。
なお,eGFRが60mL/min/1.73m2未満の腎機能障害のある患者へのアリスキレンフマル酸塩との併用については,治療上やむを得ないと判断される場合を除き避けること。 | 併用によりレニン−アンジオテンシン系阻害作用が増強される可能性がある。 |
| アンジオテンシンII受容体拮抗剤 | 腎機能障害,高カリウム血症及び低血圧を起こすおそれがあるため,腎機能,血清カリウム値及び血圧を十分に観察すること。 | 併用によりレニン−アンジオテンシン系阻害作用が増強される可能性がある。 |
| 非ステロイド性消炎鎮痛剤 | 降圧作用が減弱するおそれがある。 | プロスタグランジンの合成阻害作用により,本剤の降圧作用を減弱させる可能性がある。 |
| 非ステロイド性消炎鎮痛剤 | 腎機能を悪化させるおそれがある。 | プロスタグランジンの合成阻害作用により,腎血流量が低下するためと考えられる。 |
| カリジノゲナーゼ製剤 | 本剤との併用により過度の血圧低下が引き起こされる可能性がある。 | 血管平滑筋の弛緩が増強される可能性がある。 |
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
血管浮腫(頻度不明)
呼吸困難を伴う顔面,舌,声門,喉頭の腫脹を症状とする血管浮腫があらわれることがある。このような場合には,気管の閉塞を起こしやすくなるので,直ちに投与を中止し,アドレナリンの皮下注射,気道確保など適切な処置を行うこと。また,腹痛を伴う腸管の血管浮腫があらわれることがあるので,異常が認められた場合には,直ちに投与を中止し適切な処置を行うこと。
肝機能障害,黄疸(頻度不明)
AST(GOT),ALT(GPT),LDH,γ-GTP,Al-Pの上昇等を伴う肝機能障害,黄疸があらわれることがあるので,観察を十分に行い,異常が認められた場合には,投与を中止するなど適切な処置を行うこと。
血小板減少(頻度不明)
血小板減少があらわれることがあるので,観察を十分に行い,異常が認められた場合には,投与を中止するなど適切な処置を行うこと。
高カリウム血症(頻度不明)
重篤な高カリウム血症があらわれることがあるので,観察を十分に行い,異常が認められた場合には,直ちに適切な処置を行うこと。
天疱瘡様症状(頻度不明)
天疱瘡様症状があらわれることがあるので,紅斑,水疱,そう痒,発熱,粘膜疹等があらわれた場合には投与を中止し,適切な処置を行うこと。
重大な副作用(類薬)
汎血球減少,無顆粒球症
他のアンジオテンシン変換酵素阻害剤で,汎血球減少,無顆粒球症が報告されている。
急性腎障害,ネフローゼ症候群
他のアンジオテンシン変換酵素阻害剤で,急性腎障害,ネフローゼ症候群が報告されている。
その他の副作用
| | 頻度不明 |
| 過敏症注1) | 発疹,そう痒,蕁麻疹 |
| 血液注2) | 貧血,白血球減少,好酸球増多,血小板減少 |
| 精神神経系 | めまい,頭痛・頭重,眠気 |
| 消化器 | 嘔気,食欲不振,胃部不快感,嘔吐,下痢,腹痛 |
| 肝臓 | AST(GOT)上昇,ALT(GPT)上昇,Al-P上昇,LDH上昇,γ-GTP上昇,肝機能異常 |
| 循環器 | 動悸,低血圧 |
| 腎臓 | BUN上昇,血清クレアチニン上昇 |
| その他 | 咳嗽,咽頭不快感,CK(CPK)上昇,血清カリウム上昇,嗄声,胸部不快感,口渇,顔面潮紅,倦怠感,味覚異常,浮腫,抗核抗体の陽性例,低血糖 |
高齢者への投与
低用量(例えば1mg)から投与を開始するなど患者の状態を観察しながら慎重に投与すること。[高齢者では一般に過度の降圧は好ましくないとされている(脳梗塞等が起こるおそれがある)。]
妊婦,産婦,授乳婦等への投与
**妊婦又は妊娠している可能性のある女性には投与しないこと。また,投与中に妊娠が判明した場合には,直ちに投与を中止すること。[妊娠中期及び末期にアンジオテンシン変換酵素阻害剤又はアンジオテンシンII受容体拮抗剤を投与された患者で羊水過少症,胎児・新生児の死亡,新生児の低血圧,腎不全,高カリウム血症,頭蓋の形成不全及び羊水過少症によると推測される四肢の拘縮,頭蓋顔面の変形,肺の低形成等があらわれたとの報告がある。また,海外で実施されたレトロスペクティブな疫学調査で,妊娠初期にアンジオテンシン変換酵素阻害剤を投与された患者群において,胎児奇形の相対リスクは降圧剤が投与されていない患者群に比べ高かったとの報告がある。]
**妊娠する可能性のある女性に投与する場合には,本剤の投与に先立ち,代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し,治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また,投与が必要な場合には次の注意事項に留意すること。
本剤投与開始前に妊娠していないことを確認すること。本剤投与中も,妊娠していないことを定期的に確認すること。投与中に妊娠が判明した場合には,直ちに投与を中止すること。
次の事項について,本剤投与開始時に患者に説明すること。また,投与中も必要に応じ説明すること。
・妊娠中に本剤を使用した場合,胎児・新生児に影響を及ぼすリスクがあること。
・妊娠が判明した又は疑われる場合は,速やかに担当医に相談すること。
・妊娠を計画する場合は,担当医に相談すること。
[妊娠していることが把握されずアンジオテンシン変換酵素阻害剤又はアンジオテンシンII受容体拮抗剤を使用し,胎児・新生児への影響(腎不全,頭蓋・肺・腎の形成不全,死亡等)が認められた例が報告されている。1, 2)]
授乳中の婦人に投与することを避け,やむを得ず投与する場合には,授乳を中止させること。[動物実験(ラット)で乳汁中へ移行することが認められている。]
小児等への投与
低出生体重児,新生児,乳児,幼児又は小児に対する安全性は確立していない(使用経験が少ない)。
適用上の注意
薬剤交付時
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により,硬い鋭角部が食道粘膜へ刺入し,更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
その他の注意
インスリン又は経口血糖降下剤の投与中にアンジオテンシン変換酵素阻害剤を投与することにより,低血糖が起こりやすいとの報告がある。
薬物動態
1 生物学的同等性試験
テモカプリル塩酸塩錠1mg「日医工」及び標準製剤を,クロスオーバー法によりそれぞれ1錠(テモカプリル塩酸塩として1mg)健康成人男子に絶食単回経口投与して活性代謝物であるテモカプリラートの血漿中濃度を測定し,得られた薬物動態パラメータ(AUC,Cmax)について90%信頼区間法にて統計解析を行った結果,log(0.8)〜log(1.25)の範囲内であり,両剤の生物学的同等性が確認された。
3)また,テモカプリル塩酸塩錠2mg「日医工」及び標準製剤をそれぞれ1錠(テモカプリル塩酸塩として2mg)投与した場合,並びにテモカプリル塩酸塩錠4mg「日医工」及び標準製剤をそれぞれ1錠(テモカプリル塩酸塩として4mg)投与した場合においても,同様に両剤の生物学的同等性が確認された。
3)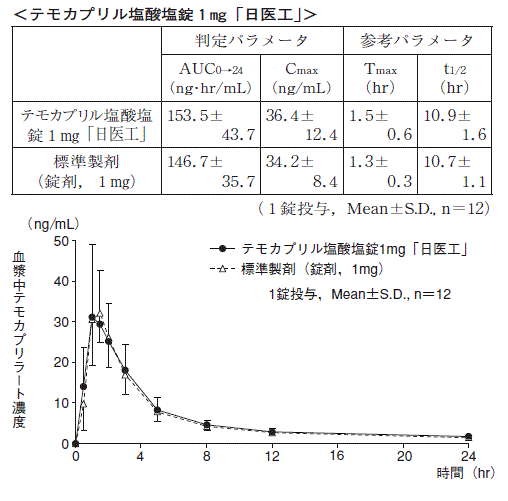
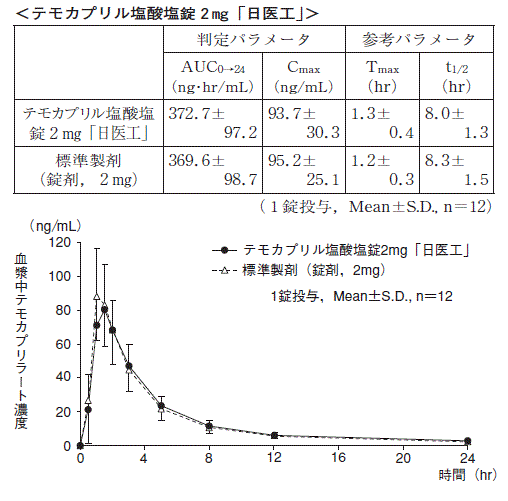
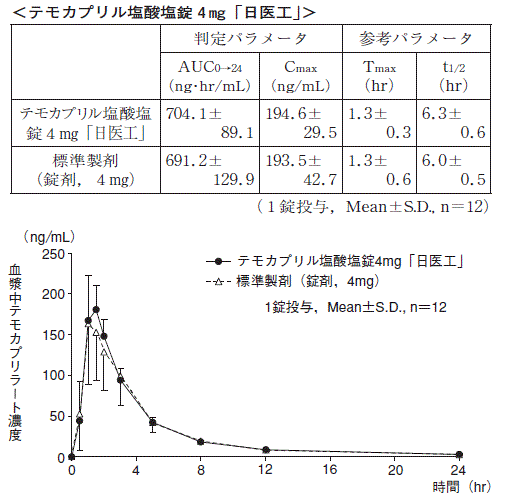
血漿中濃度並びにAUC,Cmax等のパラメータは,被験者の選択,体液の採取回数・時間等の試験条件によって異なる可能性がある。
溶出挙動
テモカプリル塩酸塩錠1mg「日医工」,テモカプリル塩酸塩錠2mg「日医工」及びテモカプリル塩酸塩錠4mg「日医工」は,日本薬局方医薬品各条に定められたテモカプリル塩酸塩錠の溶出規格に適合していることが確認されている。4)
有効成分に関する理化学的知見
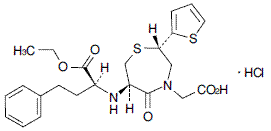
一般名
テモカプリル塩酸塩(Temocapril Hydrochloride)
化学名
2-[(2S ,6R )-6-{[(1S )-1-(Ethoxycarbonyl)-3-phenylpropyl]amino}-5-oxo-2-(thiophen-2-yl)-2,3,6,7-tetrahydro-1,4-thiazepin-4(5H )-yl]acetic acid monohydrochloride
構造式
分子式
C23H28N2O5S2・HCl
分子量
513.07
性状
白色の結晶性の粉末である。
エタノール(99.5)に溶けやすく,水に極めて溶けにくい。
取扱い上の注意
安定性試験
本品につき加速試験(40℃,相対湿度75%,6ヵ月)を行った結果,テモカプリル塩酸塩錠1mg「日医工」,テモカプリル塩酸塩錠2mg「日医工」及びテモカプリル塩酸塩錠4mg「日医工」は通常の市場流通下において3年間安定であることが推測された。5)
包装
テモカプリル塩酸塩錠1mg「日医工」
100錠(10錠×10;PTP)
テモカプリル塩酸塩錠2mg「日医工」
100錠(10錠×10;PTP)
テモカプリル塩酸塩錠4mg「日医工」
100錠(10錠×10;PTP)
主要文献及び文献請求先
主要文献
1
阿部真也 他:周産期医学.2017;47:1353-1355
2
齊藤大祐 他:鹿児島産科婦人科学会雑誌.2021;29:49-54
3
山口明志 他:医学と薬学,61(4),571(2009)
4
日医工株式会社 社内資料:溶出試験
5
日医工株式会社 社内資料:安定性試験
文献請求先
主要文献欄に記載の文献・社内資料は下記にご請求下さい。
日医工株式会社 お客様サポートセンター
〒930‐8583 富山市総曲輪1丁目6番21
フリーダイアル(0120)517-215
Fax(076)442-8948
製造販売業者等の氏名又は名称及び住所
製造販売元
日医工株式会社
富山市総曲輪1丁目6番21

 060
060 060
060

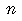 061
061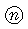 061
061
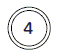

 062
062 062
062