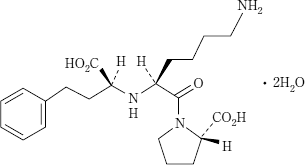
1
阿部真也他:周産期医学, 2017;47(10):1353-1355
2
齊藤大祐他:鹿児島産科婦人科学会雑誌, 2021;29:49-54
3
Cooper, W. O. et al.:N. Engl. J. Med., 2006;354(23):2443-2451
4
Herings, R. M. C. et al.:Lancet, 1995;345:1195-1198
5
Tunon-de-Lara, J. M. et al.:Lancet, 1992;340:908
6
中島光好他:薬理と治療, 1990;18(2):525-547
7
塩之入洋他:医学と薬学, 1990;23(1):161-172
8
Hogg, R. J. et al.:Pediatr. Nephrol., 2007;22:695-701
9
Gautam, P. C. et al.:J. Pharm. Pharmacol., 1987;39:929-931
10
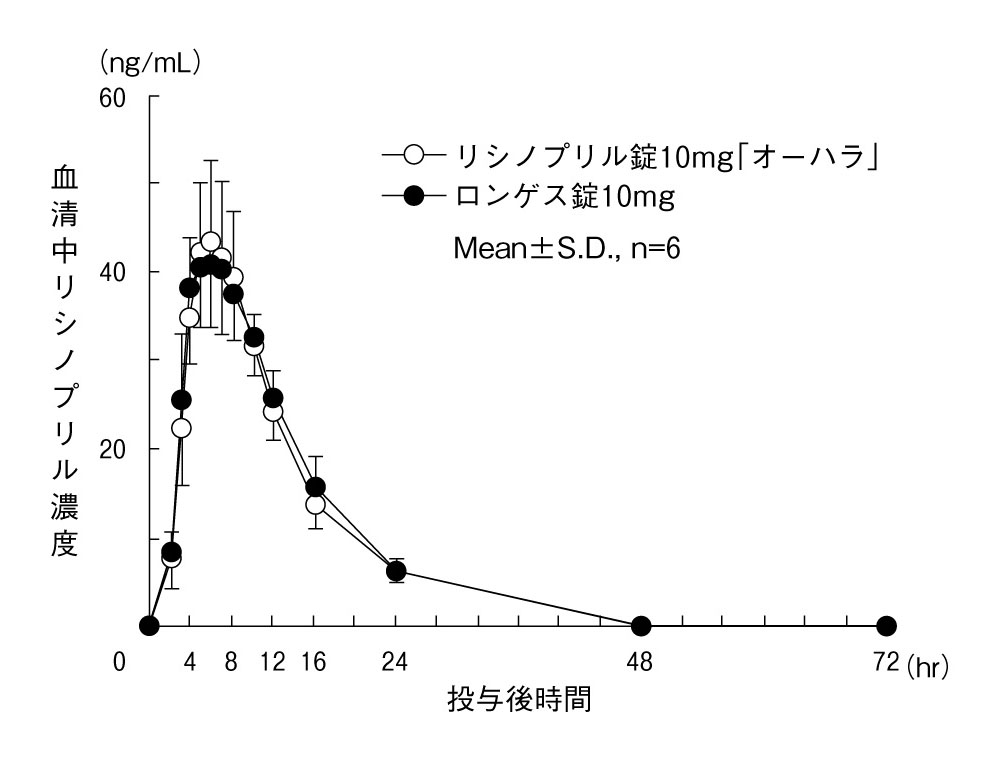
大原薬品工業株式会社 社内資料:生物学的同等性試験(錠10mg)
11
Case, D. E.:J. Hum. Hypertens., 1989;3:127-131
12
大原薬品工業株式会社 社内資料:生物学的同等性試験(錠5mg)
13
大原薬品工業株式会社 社内資料:生物学的同等性試験(錠20mg)
14
荒川規矩男他:最新医学, 1990;45(5):1031-1057
15
猿田享男他:基礎と臨床, 1990;24(3):1365-1380
16
荒川規矩男他:最新医学, 1990;45(4):834-858
17
荒川規矩男他:基礎と臨床, 1990;24(4):2041-2072
18
尾前照雄他:臨床と研究, 1990;67(4):1209-1220
19
石井當男他:基礎と臨床, 1990;24(3):1393-1406
20
飯塚昌彦他:基礎と臨床, 1993;27(13):5227-5259
21
河合忠一他:基礎と臨床, 1993;27(12):4757-4776
22
河合忠一他:基礎と臨床, 1993;27(12):4777-4805
23
津田泰夫他:臨床と研究, 1993;70(10):3309-3320
24
水谷登他:薬理と治療, 1993;21(10):3727-3737
25
第十八改正日本薬局方解説書, 廣川書店, 2021;C-6021-6026
26
阿部圭志他:基礎と臨床, 1990;24(3):1381-1392
27
別所秀樹他:応用薬理, 1989;37(3):285-295
28
織田実他:日本薬理学雑誌, 1989;93(4):225-234
29
織田実他:日本薬理学雑誌, 1989;93(4):235-243
30
川上勝他:応用薬理, 1992;44(3):295-302
31
Stone, C. K. et al.:Am. J. Cardiol., 1989;63:567-570
32
山田重行他:応用薬理, 1993;46(2):89-98
33
Wollert, K. C. et al.:J. Am. Coll. Cardiol., 1994;30A, Abs. 845-106