1
阿部真也ほか: 周産期医学. 2017; 47: 1353-1355
2
齊藤大祐ほか: 鹿児島産科婦人科学会雑誌. 2021; 29: 49-54
3
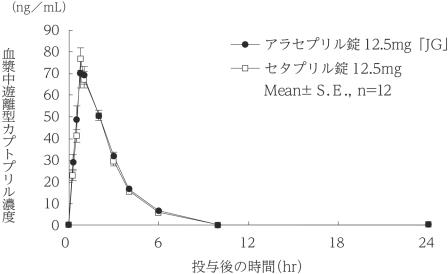
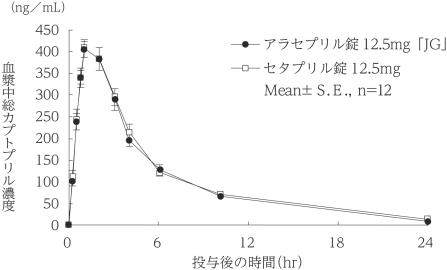
社内資料:生物学的同等性試験(12.5mg)
4
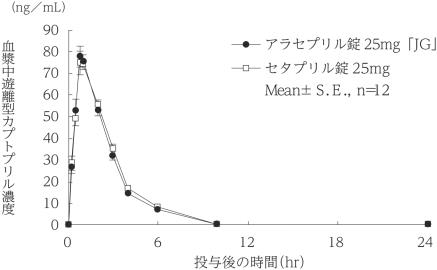
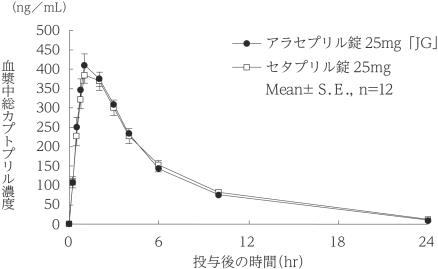
社内資料:生物学的同等性試験(25mg)
5
小野山 薫ほか: 基礎と臨床. 1985; 19: 5943-5950
6
社内資料:生物学的同等性試験(50mg)
7
Takeyama K., et al.: Arzneim.-Forsch./Drug Res. 1985; 35: 1502-1507
8
Hosoki K., et al.:Arzneim.-Forsch./Drug Res. 1986; 36:77-83
9
林 幸司ほか: 薬理と治療. 1988; 16: 637-656
10
Takeyama K., et al.: Arzneim.-Forsch./Drug Res. 1986; 36: 74-77
11
Minato H., et al.: Arzneim.-Forsch./Drug Res. 1989; 39: 319-324