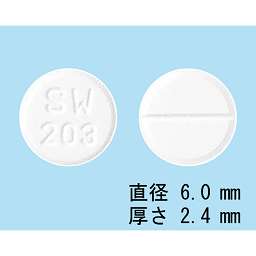
1
阿部真也他:周産期医学, 2017;47(10):1353-1355
2
齊藤大祐他:鹿児島産科婦人科学会雑誌, 2021;29:49-54
3
Augenstein, W. L. et al.:JAMA, 1988;259(22):3302-3305
4
第十八改正日本薬局方解説書, 廣川書店, 2021;C-1355-1341
5
宮崎直道他:日本腎臓学会誌, 1982;24(4):421-428
6
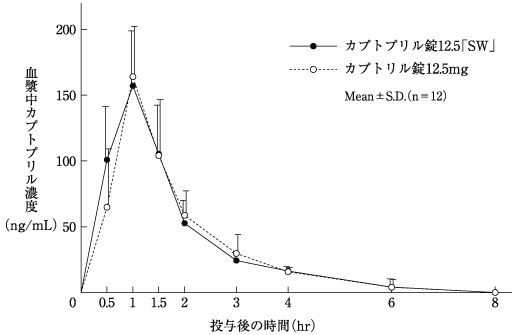
社内資料:生物学的同等性試験(錠12.5)
7
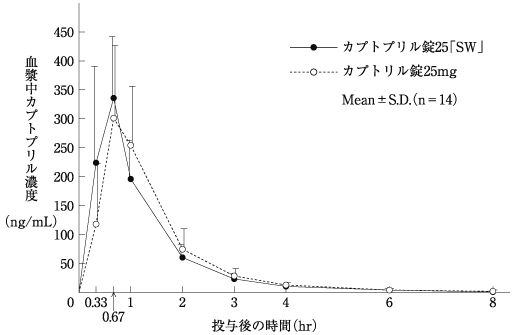
社内資料:生物学的同等性試験(錠25)
8
蔵本築他:薬理と治療, 1981;9(10):4073-4101
9
金子好宏他:医学のあゆみ, 1982;122(1):62-85
10
蔵本築他:臨床評価, 1982;10(2):303-345
11
Cushman, D. W. et al.:Prog. Cardiovasc. Dis., 1978;21(3):176-182
12
Rubin, B. et al.:J. Pharmacol. Exp. Ther., 1978;204(2):271-280
13
Laffan, R. J. et al.:J. Pharmacol. Exp. Ther., 1978;204(2):281-288
14
Koike, H. et al.:Hypertension, 1980;2(3):299-303
15
Rubin, B. et al.:Eur. J. Pharmacol., 1978;51(4):377-388
16
Antonaccio, M. J. et al.:Jpn. J. Pharmacol., 1979;29(2):285-294
17
Horovitz, Z. P. et al.:Br. J. Clin. Pharmacol., 1979;7(S2):243S-248S