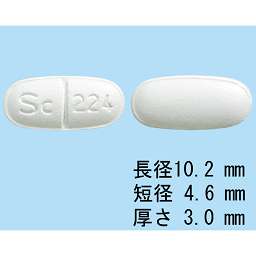
1
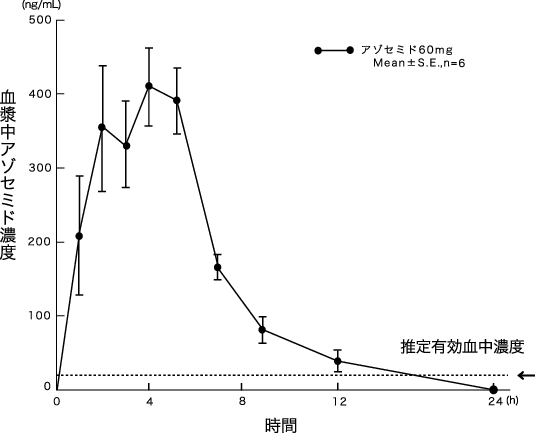
社内資料:薬物動態に関する資料
2
社内資料:ヒト経口投与後の排泄に関する資料
3
大島研三 他:基礎と臨床. 1984;18(7):3025-3039
4
大島研三 他:基礎と臨床. 1984;18(8):4117-4218
5
大島研三 他:医学のあゆみ. 1984;130(1):70-94
6
山田和生 他:基礎と臨床. 1984;18(9):4471-4490
7
社内資料:アゾセミドの心不全に対する臨床効果
8
藤沢 洌 他:肝胆膵. 1984;9(2):293-304
9
Greven J, et al.:Arzneim-Forsch. 1981;31(1)Nr 2:350-353
10
Greven J, et al.:Arzneim-Forsch. 1981;31(1)Nr 2:346-350
11
Brater DC:Clin Pharmacol Ther. 1979;25:428-434
12
林 元英 他:応用薬理. 1984;28(5):859-877
13
林 元英 他:応用薬理. 1984;28(5):837-849