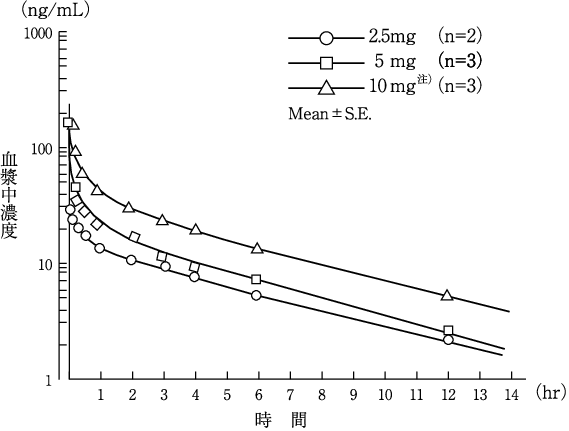
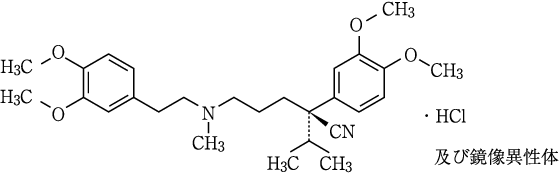
1
Kroemer H.K. et al.:Naunyn-Schmiedebergs Arch. Pharmacol., 1993;348(3):332-337 [VA-3338]
2
比江嶋一昌ら:臨牀と研究, 1981;58(10):3416-3418 [VA-0613]
3
勝目紘ら:臨牀と研究, 1981;58(4):1306-1312 [VA-0617]
4
河合忠一ら:臨牀と研究, 1984;61(12):4023-4029 [VA-1311]
5
小沢武文ら:臨牀と研究, 1985;62(5):1657-1667 [VA-1505]
6
加藤和三ら:心電図, 1985;5(1):49-68 [VA-1404]
7
Singh B.N. et al.:Drugs, 1978;15(3):169-197 [VA-2924]
8
Nabata H.:Jpn. J. Pharmacol., 1977;27(2):239-249 [VA-0226]
9
Okada T. et al.:Jpn. Circ. J., 1975;39(8):913-917 [VA-1614]
10
池田信男ら:臨牀と研究, 1977;54(12):4176-4180 [VA-0231]
11
Motomura S. et al.:Naunyn-Schmiedebergs Arch. Pharmacol., 1981;315(3):241-248 [VA-0731]
12
Narimatsu A. et al.:Naunyn-Schmiedebergs Arch. Pharmacol., 1976;294(2):169-177 [VA-0318]
13
古谷幸雄ら:麻酔, 1983;32(4):409-417 [VA-0934]
14
Fleckenstein A. et al.:Naunyn-Schmiedebergs Arch. Pharmacol., 1969;264(3):227-228 [VA-0130]